Тема урока «Общие свойства кислот»
Цель урока: закрепить и обобщить знания об особенностях класса неорганических веществ – кислот; рассмотреть и изучить физические и общие химические свойства кислот; продолжить работу с электрохимическим рядом напряжения металлов
КЛАССИФИКАЦИЯ КИСЛОТ
Кислоты – это сложные вещества, состоящие из одного или нескольких атомов водорода, связанных с кислотными остатками.
Кислоты – вещества молекулярного строения. Атомы в молекулах кислот связаны ковалентными полярными химическими связями.
Классифицировать кислоты можно по разным признакам.
· По содержанию кислорода кислоты могут быть бескислородными (например, НCl, НВг, HI, H2S, HCN) и кислородсодержащими (например, H2SO4, HNO3, H3PO4).
· По числу атомов водорода в молекуле кислоты, способных замещаться атомами металлов (по основности), кислоты могут быть одноосновными (НCl, НВг, HI, HNO3), двухосновными (H2SO4, H2SO3, H2СО3, H2S), трёхосновными (H3PO4, H3AsO4) и т. д. Существуют и кислоты большей основности, например пирофосфорная Н4Р2O7 – четырёхосновная.
· По степени диссоциации кислоты могут быть сильными (НCl, НВг, HI, HNO3, H2SO4) и слабыми (H2S, H2SiO3, H2CO3, СH3СООН).
· По растворимости кислоты могут быть растворимыми в воде (H2SO4, HNO3, НCl, СH3СООН) и нерастворимыми в воде (H2SiO3, C17H35СООН).
· По стабильности кислоты могут быть стабильными (H2SO4, НCl, H3РO4) и нестабильными (H2CO3, H2SO3, HNO2). Нестабильные кислоты, как правило, невозможно выделить в свободном состоянии, они существуют только в растворах.
· По летучести кислоты могут быть летучими (НCl, HNO3, СH3СООН) и нелетучими (H2SO4, H3PO4, H2SiO3).
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
1. Кислоты реагируют с металлами. Металлы, расположенные в электрохимическом ряду напряжений (ЭРН) металлов до водорода H2, вытесняют водород из растворов кислот. Происходит реакция замещения, образуется соль и водород:
Металл (стоящий в ЭРН до водорода) +кислота = соль + водород
Zn + 2НCl = ZnCl2 + H2↑
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Металлы, расположенные в ряду напряжений после водорода, с кислотами не реагируют.
2. Кислоты реагируют с оксидами металлов с образованием соли и воды:
Оксид металла + кислота = соль + вода
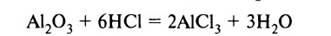
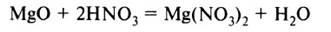
3. Кислоты реагируют с растворимыми и нерастворимыми основаниями с образованием соли и воды:
Растворимое основание + кислота = соль + вода
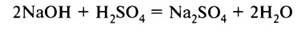
(Взаимодействие сильных кислот с сильными основаниями – реакция нейтрализации.)
Нерастворимое основание + кислота = соль + вода
Al(ОН)3 + 3НCl = AlCl3 + 3H2O
4. Сильные кислоты реагируют с солями слабых кислот. Слабые кислоты при этом могут быть вытеснены из солей. Например, сильная соляная кислота НCl вытесняет слабую сероводородную кислоту H2S:
Соль слабой кислоты + сильная кислота = новая соль + новая кислота
FeS + 2НCl = FeCl2 + H2S↑
5. Кислоты можно обнаружить индикаторами. Индикаторы изменяют свой цвет в зависимости от среды. Лакмус в кислой среде приобретает красный цвет, метиловый оранжевый – красный, фенолфталеин – бесцветный. Для обнаружения кислот удобно использовать лакмус.
Таблица 1
 2020-05-25
2020-05-25 99
99







