В методических материалах по ЕГЭ рассматриваются следующие реакции:
а) ионы железа(III) в щелочной среде образуют бурый осадок гидроксида:
Fe+3 + 3OH– = Fe(OH)3¯
т.о. Fe+3 ионы можно обнаружить, добавив раствор щелочи или раствор соли, гидролизующейся по аниону;
б) ионы железа(III) и роданид-ионы SCN– образуют комплексную соль винно-красного цвета, упрощенно:
FeCl3 + 3NН4SCN = Fe(SCN)3 + 3NН4Cl
в) наиболее известная аналитическая реакция и ионов Fe+3 и Fe+2 – образование ярко-синего комплексного соединения KFe3+[Fe+2(CN)6], известного под названиями берлинская лазурь или турнбулева синь.
Это соединение образуется, если к раствору соли железа(II) добавить гексацианоферрат(III) калия K3[Fe(CN)6] (т.н. красная кровяная соль), например:
FeSO4 + K3[Fe(CN)6] = KFe3+[Fe+2(CN)6]¯ + K2SO4
Оно же образуется, если к раствору соли железа(III) добавить гексацианоферрат(II) калия (т.н. желтая кровяная соль), например:
FeCl3 + K4[Fe(CN)6] = KFe3+[Fe+2(CN)6]¯ +3KCl
Применение железа и его соединений
Железо является основным компонентом сталей и чугунов – важнейших конструкционных материалов.
Оксиды железа используются как пигменты, как катализаторы в химической промышленности.
Хлорид железа(III) (т.н. хлорное железо) в растворе способно окислять малоактивные металлы медь и ртуть, его используют для травления печатных плат и для удаления металлической ртути.
Медь
Медь переходный металл золотисто-красного цвета, обладает высокой тепло- и электропроводностью, пластична.
Медь относится к благородным металлам (в ряду активности расположена после водорода). В природе встречается самородная медь, важнейшими минералами меди являются халькопирит CuFeS2 (медный колчедан), медный купорос CuSO4×5H2O, малахит (CuOH)2CO3.
Получение меди
Из-за малой активности, медь достаточно легко восстановить из соединений. C давних пор использовалась прямая выплавка из малахита:
(CuOH)2CO3 + 2СО = 2Cu + 3СО2 + Н2O
В настоящее время медь получают, преимущественно, из халькопирита CuFeS2, причем восстановителем является сама сульфидная сера.
В лаборатории медь можно легко получить из оксидов – темно-красного Cu2O или черного CuO, эти реакции часто встречаются в заданиях повышенной сложности:
CuO + H2 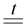 Cu + H2O
Cu + H2O
Cu2O + СО 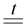 2Cu + СО2
2Cu + СО2
3CuO + 2NH3 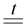 3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
CuO + С 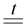 Cu + СO
Cu + СO
 2020-05-25
2020-05-25 149
149








