В соединениях медь проявляет две степени окисления: +1 и +2. Медь слабый восстановитель, окислить ее можно только сильными окислителями.
1. Из простых веществ медь реагирует только с кислородом, галогенами, серой:
Cu + O2 (избыток)  CuO
CuO
Cu + O2 (недостаток)  Cu2O
Cu2O
Cu + Cl2 = CuCl2
Cu + S 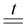 CuS
CuS
2. Медь растворяется в азотной и концентрированной серной кислоте:
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO + 4Н2O
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 + 2Н2O
Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2Н2O
3. Медь не растворяется в воде, в кислотах-неокислителях, но в присутствии кислорода идут реакции:
2Cu + 4HCl + O2 = 2CuCl2 + 2Н2O
2Cu + СО2 + Н2O + O2 = (CuOH)2CO3
4. Медь – d -элемент, сильный комплексообразователь. Ион Cu2+ в водном растворе существует в виде иона тетрааквамеди [Cu(Н2O)4]2+ голубого цвета, без воды ион меди бесцветный. В присутствии аммиака образуется более стойкий аммиачный комплекс [Cu(NН3)4]2+ ярко-синего цвета, например:
[Cu(Н2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ + 4Н2O
или в молекулярном виде (молекулы воды обычно не указывают):
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
голубой ярко-синий
Аммиачный комплекс меди образуется при растворении гидроксида меди(II) и даже оксида меди(II) в растворе аммиака:
Cu(OH)2¯ + 4NH3×Н2O = [Cu(NH3)4](OH)2 + 4Н2O
CuO + 4NH3×Н2O = [Cu(NH3)4](OH)2 + 3Н2O
5. Как и железо, медь имеет две степени окисления, поэтому возможны реакции:
Cu0 + Cu+2O  Cu+12O
Cu+12O
Cu0 + Cu+2Cl2 + 2NaCl = 2Na[Cu+1Cl2]
Последняя реакция протекает, так как образуется устойчивый комплексный ион.
Аналитическое определение меди
При внесении солей меди в пламя горелки, пламя окрашивается в зелёно-голубой цвет.
В отсутствии других катионов (например, никеля), ионы меди можно обнаружить по характерной голубой (зелёно-голубой) окраске раствора и по переходу окраски в ярко-синий в присутствии аммиака.
При пропускании через раствор, содержащий ионы меди, сероводорода наблюдается выпадение черного осадка:
Cu2+ + Н2S = CuS¯ + 2Н+
Применение меди
Металлическая медь используется в электротехнике, при производстве труб, теплообменных устройств. Широко используются сплавы на основе меди – бронзы, латуни. Соединения меди применяются в качестве катализаторов.
Цинк
Цинк мягкий белый металл, на воздухе покрыт прочной оксидной пленкой. Основные минералы – сульфид и карбонат цинка. Для получения металлического цинка их обжигают:
ZnCO3  ZnO + CO2
ZnO + CO2
2ZnS + 3O2 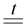 2ZnO + 2SO2
2ZnO + 2SO2
Полученный оксид восстанавливают углеродом:
ZnO + С  Zn + СO
Zn + СO
 2020-05-25
2020-05-25 278
278








