Молочная, винная и лимонная кислоты – это ациклические оксикислоты, содержащие одновременно спиртовой гидроксил и карбоксильную группу. Их можно рассматривать как гидроксильные производные карбоновых кислот.
Так, при замещении водорода в радикале пропионовой кислоты спиртовым гидроксилом получается оксипропионовая или молочная кислота:
*
СН3 - СН2 - СООН → СН3 – СН(ОН) – СООН;
при замещении водорода в двух радикалах янтарной кислоты образуется диоксиянтарная, или винная кислота
* *
НООС – СН2 - СН2 - СООН → НООС – СН(ОН) – СН(ОН) – СООН;
при замещении в одном радикале трикарбаллиловой кислоты – окситрикарбаллиловая, или лимонная кислота:
СООН СООН
| |
НООС – СН2 – СН – СН2 - СООН → НООС – СН2 – С(ОН) – СН2 – СООН
Основность оксикислот определяется числом карбоксильных групп, а атомность – числом гидроксилов, включая и гидроксилы карбоксильных групп.
Таким образом, молочная кислота – одноосновная двухатомная оксикислота, винная и лимонная – соответственно двух- и трехосновные многоатомные оксикислоты.
Винная и лимонная кислоты – кристаллические продукты. Молочная кислота в определенных условиях также может существовать в кристаллической форме, но как правило, представляет собой сиропообразную жидкость. Благодаря наличию спиртового гидроксила эти кислоты хорошо растворяются в воде, причем их растворимость возрастает с повышением температуры.
Оксикислотам как соединениям со смешанными функциями присущи одновременно все свойства кислот и спиртов.
Свойства, зависящие от карбоксила.
Электролитическая диссоциация.
Это – свойство электролитов при растворении распадаться на разноименно заряженные ионы.
В зависимости от числа карбоксилов в молекуле оксикислоты она диссоциирует в одну, две или три ступени.
В частности лимонная кислота диссоциирует в три ступени:
Н3Ci + H2O «H3O1 + H2Ci1-;
Н2Ci1- + H2O «H3Ci2- + H3O1+;
НCi2- + H2O «H3Ci2- + Ci3- + H3O1+;
где Ci – анион кислоты (цитрат); H3O1+- катион.
Образование солей.
Соли молочной кислоты называют лактатами, винной – тартратами, лимонной – цитратами.
Образование сложных эфиров
При замещении гидроксила в карбоксильной группе остатком спирта образуются сложные эфиры, например метиловый эфир молочной кислоты
СН3 – СН(ОН) – СООН + НО – СН3→ СН3 – СНОН – СО – О – СН3 – Н2О
Свойства, зависящие от спиртового гидроксила
В отличие от обычных кислот, оксикислоты способны окисляться. При окислении оксикислоты получаются кетонокислоты, например из молочной кислоты – пировиноградная кислота:
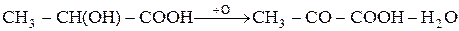
При замещении в спиртовом гидроксиле оксикислоты атома водорода остатком кислоты образуются сложные эфиры
Формула
а при замещении его радикалом – простые эфиры.
Формула
Реакции, характерные только для оксикислот
При нагревании с разбавленной минеральной кислотой от оксикислот отщепляется муравьиная кислота и образуется соответствующий альдегид или кетон.
Формула
Из лимонной кислоты наряду с муравьиной образуется ацетон-дикарбоновая кислота СООН-СН2-СО-СН2-СООН.
При температуре 170 оС и выше первоначальным продуктом дегидратации лимонной кислоты является аконитовая кислота, при разложении которой отгоняется смесь ангидридов цитраконовой и таконовой кислот.
Формула
Молочная кислота в виду присутствия в ее молекулах одновременно карбоксила и спиртового гидроксила способна к взаимной этерификации. При этом из двух молекул кислоты образуется лакитилмолочная кислота.
Формула
Из трех молекул – дилактилмолочная кислота и т.д., вплоть до полилактилмолочной кислоты.
Молочная кислота
Молочная кислота в природе содержится в ряде растений, а также в продуктах, полученных в результате молочнокислого брожения (кисломолочные продукты, квашенные овощи, хлеб).
В чистом виде – это бесцветная прозрачная жидкость, без запаха, с кислым вкусом. Молочная кислота является химически нестойким соединением. Она образует разные продукты дегидратации, называемые условно ангидридами молочной кислоты. Эти продукты имеют менее выраженный кислый вкус.
Получаемая промышленным способом пищевая молочная кислота представляет собой водный раствор смеси молочной кислоты и ее ангидридов, хорошо растворяется в в оде, спирте и эфире. Молочная кислота широко применяется в пищевой, фармацевтической, химической и других отраслях промышленности.
В пищевой промышленности эта кислота используется в производстве конфет, безалкогольных и ликероводочных напитков, фруктовых соков, эссенций, в хлебопекарном производстве. Молочную кислоту получают сбраживанием сахаров молочнокислыми бактериями.
Суммарное уравнение брожения можно представить так:
С6Н12О6→2СН3СНОНСООН + 75,36 Дж.
Оптимальными условиями молочнокислого брожения являются: концентрация сахара в питательной среде 4-5 %, рН среды 6,3-6,5, температура брожения 50 оС.
Принципиальная технологическая схема получения молочной кислоты включает следующие технологически операции: приготовление сусла, брожение сусла, выделение лактата кальция, расщепление лактата кальция, упаривание и очистка молочной кислоты, расфасовка и хранение.
Лимонная кислота
Лимонная кислота широко распространена в растительном сырье: в клюкве 1,5 %, соке граната – 9 %, недозрелых лимонах – 6 %. В промышленности ее производят биохимическим путем, заключающемся в сбраживании сахара в лимонную кислоту плесневыми грибами Aspergillus niger. Лимонную кислоту применяют в производстве безалкогольных напитков, кондитерских изделий, в текстильном производстве, в медицине.
В качестве сахаросодержащего сырья используют свеклосахарную мелассу или сахарную крошку. Принципиальная технологическая схема получения лимонной кислоты включает следующие технологические операции: приготовление питательной среды; брожение; получение цитрата кальция, разложение цитрата кальция, упаривание раствора лимонной кислоты; кристаллизация; сушка, упаковка.
1. Приготовление питательной среды. Ферментатор наполняют подготовленным стерильным раствором мелассы, добавляют стерильные растворы питательных солей и стерильной водой доводят концентрацию питательной среды до 3-4 % (по сахара), t – 32-33 оС. Питательную среду засевают выращенным в посевном ферментаторе мицелием плесневого гриба.
2. Сбраживание. Для активного роста гриба и кислотонакопления поддерживают температуру 31-32 оС, концентрация сахара в питательной среде 3-4 %. Для восполнения сброженных сахаров периодически в ферментер добавляют свежий раствор мелассы концентрацией 25-28 %.
Длительность процесса кислотонакопления зависит от активности гриба и длится 5-10 сут. Сброженный раствор нагревают до 60 65 оС, отделяют мицелий и фильтруют. Полученный фильтрат представляет собой смесь лимонной, глюконовой и щавелевой кислот.
3. Получение цитрата кальция. Для отделения лимонной кислоты к сброженному отфильтрованному горячему раствору добавляют известковое или меловое молоко до рН 6,8-7,5. В осадок выпадают кальциевые соли лимонной и щавелевой кислот – цитрат и оксалат кальция. В растворе остается глюконат кальция, т.к. он хорошо растворим в горячей воде. Полученные нерастворимые соли – цитрат и оксалат кальция – отфильтровывают из раствора, промывают горячей водой, подсушивают.
4. Разложение цитрата кальция. Для получения лимонной кислоты в свободном состоянии осадок в реакторе обрабатывают серной кислотой. Количество серной кислоты строго дозируют с тем, чтобы разложился только цитрат кальция. Для разложения оксалата кальция в присутствии лимонной кислоты необходим большой избыток серной кислоты. После разложения цитрата кальция раствор лимонной кислоты очищают от солей железа и тяжелых металлов, фильтруют.
5. Упаривание и кристаллизация. После фильтрации раствор лимонной кислоты упаривают до концентрации лимонной кислоты в растворе 80 %. Упаренный концентрированный раствор лимонной кислоты подают в кристаллизатор. По окончании процесса кристаллизации кристаллы отделяют от маточного раствора, промывают холодной водой и сушат при температуре не выше 35 оС.
Винная кислота
Винная, или виннокаменная кислота содержится в винограде, яблоках, томате. Для получения винной кислоты используют отходы виноделия (винный камень, образующийся в бочках при длительном хранении в них виноградных вин), а также виноградные выжимки, высушенную дрожжевую гущу.
Производство винной кислоты включает следующие технологические операции: извлечение винной кислоты из сырья, получение осадка виннокислого кальция, разложение виннокислого кальция, упаривание, кристаллизация, перекристаллизация.
 2020-05-25
2020-05-25 538
538







