Https://vk.com/id71631766
Лекция по физике
Тема: «Газовые законы. Абсолютный нуль температуры.»
Подготовила Коробейникова Е. Е.
Тема Газовые законы
План
Уравнение состояния идеального газа
Уравнение Менделеева-Клапейрона
Уравнение Клапейрона
Газовые законы
4.1. Закон Бойля - Мариотта
4.2. Закон Гей-Люссака
4.3. Закон Шарля
Графические задачи на газовые законы
Уравнение состояния идеального газа определяет связь температуры, объема и давления тел.
· Позволяет определить одну извеличин, характеризующих состояние газа, по двум другим (используется в термометрах);
· Определить, как протекают процессы при определенных внешних условиях;
· Определить, как меняется состояние системы, если она совершает работу или получает тепло от внешних тел.
Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа)

- универсальная газовая постоянная, R = kNA
Уравнение Клапейрона (объединенный газовый закон)
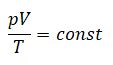
Частными случаями уравнения являются газовые законы, описывающие изопроцессы в идеальных газах, т.е. процессы, при которых один из макропараметров (T, P, V) в закрытой изолированной системе постоянный.
Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами.
Газовые законы
Закон Бойля - Мариотта
Первый газовый закон был открыт английским ученым Р. Бойлем (1627—1691) в 1660 г. Работа Бойля называлась «Новые эксперименты, касающиеся воздушной пружины». И действительно, газ ведет себя подобно сжатой пружине, в этом можно убедиться, сжимая воздух в обычном велосипедном насосе.
Бойль изучал изменение давления газа в зависимости от объема при постоянной температуре. Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим (от греческих слов isos — равный, therme — тепло).
Независимо от Бойля несколько позднее французский ученый Э. Мариотт (1620—1684) пришел к тем же выводам. Поэтому найденный закон получил название закона Бойля—Мариотта.
Произведение давления газа данной массы на его объем постоянно, если температура не меняется
pV = const
Закон Гей-Люссака
Сообщение об открытии еще одного газового закона было опубликовано лишь в 1802 г., спустя почти 150 лет после открытия закона Бойля—Мариотта. Закон, определяющий зависимость объема газа от температуры при постоянном давлении (и неизменной массе), был установлен французским ученым Гей-Люссаком (1778— 1850).
Относительное изменение объема газа данной массы при постоянном давлении прямо пропорционально изменению температуры
V = V0 αT
Закон Шарля
Зависимость давления газа от температуры при постоянном объеме экспериментально установил французский физик Ж. Шарль (1746—1823) в 1787 г.
Ж. Шарль в 1787 г., т. е. раньше, чем Гей-Люссак, установил и зависимость объема от температуры при постоянном давлении, но он своевременно не опубликовал своих работ.
Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре.
p = p0 γT
| Название | Формулировка | Графики |
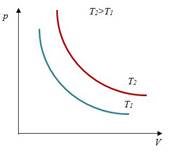
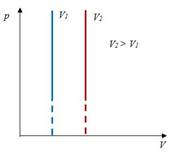
Закон Бойля-Мариотта– изотермический процесс
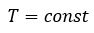
| Для данной массы газа произведение давления на объем постоянно, если температура не меняется
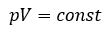
|   
|
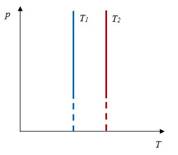
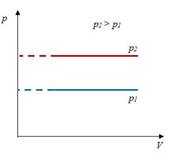
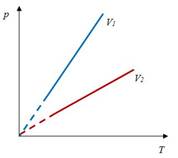
Закон Гей-Люссака– изобарный процесс
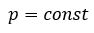
| Для данной массы газа отношение объема к температуре постоянно, если давление не меняется
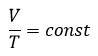
|   
|
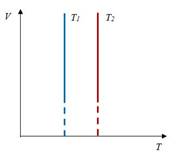
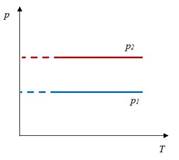
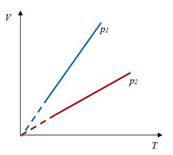
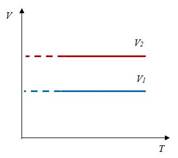
Закон Шарля– изохорный процесс
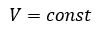
| Для данной массы газа отношение давления к температуре постоянно, если объем не меняется
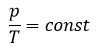
|   
|
 2020-05-21
2020-05-21 480
480







