1. Зависимость давление пара магния над раствором Mg – Pb, содержащим 4,2% магния от температуры описывается уравнением 
, а над чистым магнием

Определите 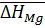 ;
;  .
.
Вычтем из первого уравнения второе:







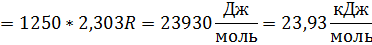
Ответ:  = -23,93 кДж/моль;
= -23,93 кДж/моль;  = 9,69 Дж/моль К.
= 9,69 Дж/моль К.
2. Температура замерзания чистого бензола 278,500 К, а температура замерзания раствора, содержащего 0,2242 г камфары и 30, 55 г бензола равна 278,254 К. Криоскопическая постоянная бензола 5,16 К. Определите молекулярную массу камфары.


В данной задаче нужно быть крайне внимательным с размерностями, а также помнить, что минимальная молярная масса вещества составляет 2 г/моль.
Ответ: 154 г/моль.
3. Температура замерзания разбавленного водного раствора тростникового сахара 272,171 К. Давление пара чистой воды при этой температуре 568,6 Па, а теплота плавления льда 6029 Дж/моль. Вычислите давление пара растворителя над раствором.
За компонент «1» примем воду, за компонент «2» - сахар.
Найдём криоскопическую постоянную для воды:

В размерности криоскопической постоянной часто опускают кг/моль.
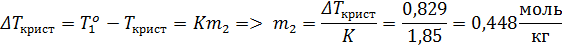
Переведём моляльность растворённого вещества в мольную долю:
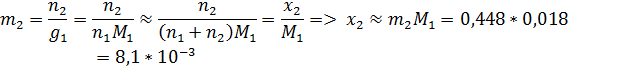
Запишем закон Рауля:

Ответ: К = 1,85 К; m2 = 0,448 моль/кг р-ля; x2 = 0,0081; P1 = 564 Па.
4. Рассчитайте осмотическое давление 0,01 молярного раствора Na2SO4 при 300 К. Кажущаяся степень диссоциации α = 0,88.
Кажущаяся степень диссоциации – степень диссоциации в гипотетическом процессе диссоциации, при котором электролит либо диссоциирует по всем ступеням, либо ни по одной, а количество образованных ионов равно количеству в реальном растворе.


Ответ: i = 2,76; π = 6,884 * 104 Па = 0,68 атм.
5. При температуре 273 К для водных растворов константа Генри для кислорода равна 1,91 * 107 Па, а для азота 4,09 * 107 Па. В воздухе мольная доля кислорода 0,2. Какова растворимость в воде азота и кислорода при общем давлении воздуха 105 Па.
За xi обозначим мольную долю i-го компонента в жидкости, а за yi – в паровой фазе.
Запишем закон Генри и закон Дальтона:




Ответ: ХО2 = 1,05 * 10-3; XN2 = 1,96 * 10-3.
6. В системе ацетон – эфир при 30 ºС при мольной доле ацетона в растворе 0,5 парциальное давление ацетона над раствором составляет 168 мм рт. ст. Давление насыщенного пара чистого ацетона 283 мм рт. ст. Константа Генри для ацетона 588 мм рт. ст. Найти аац; γац 2-мя различными способами.
Запишем закон Рауля:


Запишем закон Генри:


Получились принципиально разные значения. Необходимо учесть, что закон Генри выполняется вблизи чистого растворителя, поэтому величина определённая по закону Генри при мольной доле растворённого вещества = 0,5 не имеет смысла.
Ответ: по закону Рауля аац = 0,5936; γац = 1,187; по закону Генри аац = 0,2857; γац = 0,5714.
 2020-05-25
2020-05-25 776
776






