Раствор замерзает при более низкой температуре, чем чистый растворитель. Обозначим температуру замерзания раствора через t, температуру замерзания чистого растворителя через t0, понижение температуры замерзания раствора через Δ t, тогда
Δ t = t0 – t.
Изменение понижения температуры начала замерзания по сравнению с температурой замерзания чистого растворителя называется криоскопией.
Известно, также, что раствор кипит при более высокой температуре, чем чистый растворитель. Обозначим температуру кипения раствора через t′, температуру кипения чистого растворителя через t0′, повышение температуры кипения раствора через Δ t′, тогда
Δ t′ = t′ + t0′.
Изменение повышения температуры начала кипения раствора по сравнению с температурой кипения чистого растворителя, называется эбулиоскопией.
Опытным путем было установлено, что как понижение температуры замерзания, так и повышение температуры кипения раствора пропорционально концентрации растворенного вещества (2-ой закон Рауля), т.е.
Δ t = К∙С, Δ t′ = Е∙С,
где К и Е – коэффициенты пропорциональности,
При С = 1, Δ t′ = Е, Δ t = К.
Коэффициент К получил название криоскопической постоянной; эта постоянная означает понижение температуры замерзания раствора при его моляльной концентрации, равной единице. В этом физический смысл К.
Коэффициент Е называется эбулиоскопической постоянной. Е означает повышение температуры кипения раствора при его моляльной концентрации, равной единице. В этом физический смысл Е.
К и Е зависят только от химической природы растворителя и не зависят от природы растворенного вещества. Величины К и Е для различных растворителей приведены в табл. 6.
Методами криоскопии и эбулиоскопии легко определяется молекулярная масса неэлектролита.
Методы криоскопии и эбулиоскопии позволяют также определить степень диссоциации слабого электролита в растворе.
При растворении электролита в растворителе, электролит диссоциирует на ионы и число частиц в растворе больше, чем в случае растворения неэлектролита. Это обуславливает рост Δ t и Δ t′ :
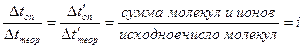 ,
,
где Δ tоп – понижение температуры замерзания раствора, определенное опытным путем;
Δ tтеор – понижение температуры замерзания раствора, вычисленное теоретически;
Δt′оп – повышение температуры кипения раствора, вычисленное опытным путем;
Δt′ теор – повышение температуры раствора, вычисленное теоретически;
i – поправочный коэффициент или коэффициент Вант-Гоффа (для растворов электролитов он всегда > 1, для неэлектролитов равен 1).
Зависимость между i и α следующая:
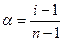 ,
,
но 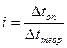 или
или 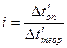 , тогда
, тогда
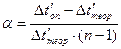
Последние два уравнения показывают, что для экспериментального определения α электролита надо измерить лишь понижение его температуры замерзания Δ tоп или повышение его температуры кипения Δ t′оп.
На практике определение степени диссоциации электролита производится по измерениям понижениям температуры замерзания раствора (редко по повышению температуры кипения), поскольку эти измерения легче экспериментально осуществить, а определения получаются более точными.
 2015-01-07
2015-01-07 2224
2224








