1. Влияние добавок на коррозионную стойкость стали
2. Методика анализа коррозионной стойкости.
3. Объясните зависимости скорости коррозии от количества каждой примеси.
4. Объясните зависимости влияния длительной эксплуатации на коррозию сталей (I, II, III и IV)
5 Методика выполнения работы.
Лабораторная работа №6 Изучение кинетики окисления металлов при высоких температурах
Цель работы. С помощью гравиметрического метода изучить кинетику газовой коррозии (окисления) металлов в воздушной среде в зависимости от температуры и времени.
Теоретическая часть
Газовая коррозия металлов является одним из видов химической коррозии. Кинетика (скорость) этого вида коррозии зависит как от внешних, так и от внутренних факторов.
В данной работе рассмотрим влияние внешних факторов, к которым относятся температура газовой среды, режим нагрева при термической обработке или обработке металлов давлением, состав газовой среды, скорость движения газовой среды и другие.
Температура. Температура очень сильно влияет на кинетику газовой коррозии. С повышением температуры интенсивность окисления металлов и сплавов сильно возрастает, так как повышается скорость диффузии, что приводит к увеличению константы скорости окисления. Температурная зависимость константны скорости окисления подчиняется экспоненциальному закону:
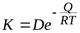 ,
,
где: К - константа скорости химической реакции;
D - постоянная, равная К при 1/ Т =0;
Q - энергия активации химической реакции;
R - газовая постоянная
Т - температура, К.
Из уравнения следует, что скорость газовой коррозии (K m) в зависимости от температуры возрастает по экспоненциальному закону (рисунок). В координатах 1/ T – lg K m эта зависимость выражается ломаной линией (рисунок 10).
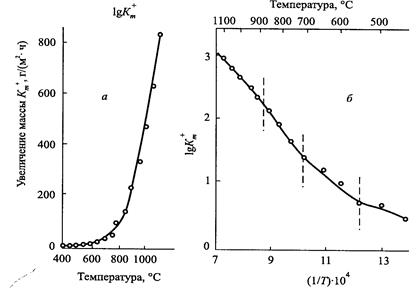
Рисунок 10-Зависимость скорости газовой коррозии от температуры
Устойчивость металлов против коррозии при высокой температуре, называется жаростойкостью.
При повышении температуры увеличивается скорость химических процессов и усиливается газовая коррозия. Пленки начинают утолщаться за счет взаимной диффузии металла и реагента через ранее образовавшийся слой продуктов коррозии.
Увеличение толщины пленки на различных металлах протекает по различным законам (в зависимости от природы образующихся окислов и сплошности покрытия):
1. По прямолинейном', согласно уравнению у = K1 τ;
2. По параболическому, согласно уравнению у2 = К2τ;
3. По логарифмическому, согласно уравнению у = К3 lg τ.
Здесь у - толщина пленки; τ - время; K1, К2, К3 - константы, зависящие от температуры и природы образующихся окислов.
Окисление по первому закону происходит в том случае, если образующаяся пленка окиси не предохраняет металл от окисления. Это имеет место при окислении таких металлов, на которых образуются несплошная пленка (щелочные и щелочноземельные) или летучие продукты окисления (при этом у характеризует потерю в весе).
Скорость газовой коррозии зависит как от химических свойства металла и газа так и от свойств образовавшейся плёнки продуктов коррозии – окислов.
Плёнка с большим числом трещин и пор не затрудняет доступа газа к поверхности металла и не вызывает замедления коррозии.
Если же плёнка прочно держится на поверхности металла и обладает незначительным числом пор и трещин, то она защищает металл от окислений, скорость коррозии и со временем уменьшается.
Дальнейшее окисление происходит как вследствие доступа воздуха к поверхности металла по порам и трещинам, так и вследствие двухсторонней диффузии газа и металла навстречу друг другу.
Зависимость скорости газовой коррозии от температуры чаще всего имеет более сложный характер, так как с изменением температуры могут изменяться структура и свойства как металла, так и продуктов коррозии. Если продукты коррозии рыхлые, легко осыпаются с поверхности металла, то они не затрудняют доступа к ней газа (большей частью кислорода воздуха) и не замедляют коррозии. Если продукты коррозии затрудняют доступ газа к поверхности металла, то они замедляют коррозию.
Однако окисление металлов по тому или иному закону в чистом виде обычно не происходит. При изменении температуры наблюдается изменение закона окисления почти для всех металлов. При более низких температурах окисление часто происходит по логарифмическому закону, при более высоких температурах — по параболическом). Для некоторых металлов (молибден, вольфрам) при высоких температурах окисление следует закону прямой линии, когда образующиеся окислы становятся летучими. При длительном испытании некоторых металлов и сплавов, содержащих эти металлы (хром, алюминий, кремний), при определенных температурах также наблюдается искажение основного закона окисления-кривые обращаются в прямые линии, почти параллельные оси времени. В этом случае процесс газовой коррозии практически прекращается, и константа скорости окисления становится близкой к нулю.
Отклонения от того или иного закона находятся в тесной связи со строением образующихся продуктов окисления, с их прочностью и сплошностью.
Строение продуктов коррозии на железе при окислении (наиболее распространенном виде газовой коррозии) соответствует диаграмме состояния железо - кислород (рисунок 11).
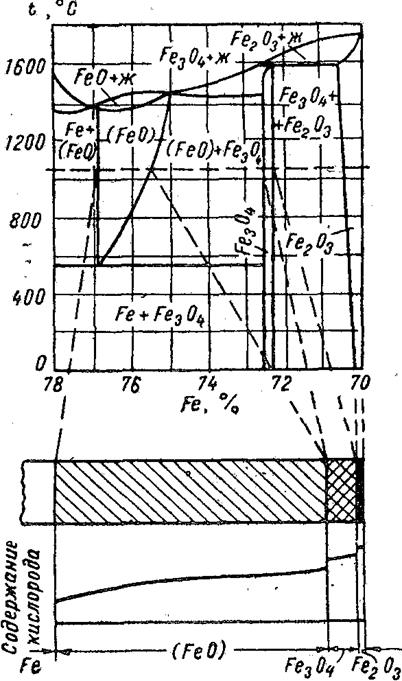
Рисунок 11- Диаграмме состояния железо – кислород и строение продуктов коррозии
Продукты коррозии состоят из:
- до температуры 575 гематита(Fe2O3) и магнетита(Fe3O4С образуется);
– выше 575 вюстит (FeO) и продукты коррозии будут иметь три слоя (по мере удаления от поверхности внутрь металла) - гематит, магнетит, вюстит.
Дальнейшее повышение температуры не приводит к появлению новых фаз в продуктах коррозии, а образовавшиеся три слоя увеличиваются по толщине. Толщина образующихся продуктов коррозии зависит от температуры и времени, при этом рост пленки во времени подчиняется параболическому или логарифмическому закону.
Режим нагрева при термической обработке или при обработке металлов давлением. Скорость газовой коррозии металлов увеличивается при колебаниях температуры нагрева и особенно сильно при переменном нагреве и охлаждении. В таких случаях в продуктах коррозии возникают термические напряжения, которые сопровождаются образованием трещин, например, в оксидной пленке, и ее отслаиванием.
Состав газовой среды. Состав газовой среды оказывает существенное влияние на скорость коррозии, но оно специфично для разных металлов, зависит от температуры и присутствия агрессивных газов. К числу таких газов относятся кислород, пары воды, водород, углекислый газ, сернистые соединения. В атмосфере SO2С, а медь в этих условиях обладает высокой коррозионной стойкостью; хром устойчив против газовой коррозии в кислороде, парах воды, SO очень сильно корродирует никель в интервале температур 700...9002, углекислом газе. На газовую коррозию железа и стали особенно сильно влияют соединения серы, пары воды и кислород.
Наиболее сильное влияние на коррозионную стойкость оказывает совместное присутствие в атмосфере паров воды и соединений серы. Скорость газовой коррозии в таких средах увеличивается в 2...3 раза. Окись углерода, наоборот, значительно снижает скорость коррозии стали и может свести ее к нулю.
Следует отметить, что при высокой концентрации СО возникает вероятность науглероживания поверхности стали.
Наиболее вредные газы - хлор и хлористый водород, так как при повышении температуры хлориды многих металлов становятся летучими. В этом случае на поверхности металла отсутствует защитный слой, и металл окисляется с большой скоростью по закону прямой линии.
Скорость движения газовой среды. С увеличением скорости движения газовой среды скорость коррозии увеличивается до некоторого предела, выше которого остается практически постоянной.
Предельные значения скорости коррозии при данной температуре достигаются, как иногда утверждают, при малых скоростях газового потока. Однако, вопрос влияния скорости движения газовой среды на кинетику коррозии изучен еще недостаточно.
Скорость газовой коррозии обычно определяется по изменению веса испытуемого образца. Если в результате коррозии получается хорошо держащееся на его поверхности окалина, то определяют увеличение веса образца; если же продукты окисления не удаётся сохранить полностью, то окалину удаляют и определяют потерю веса образца.
Увеличение и уменьшение веса относят к единице поверхности образца и к определённому промежутку времени.
Изучение кинетики окисления металлов можно производить, различными методами:
1. Путем непрерывного нагрева и взвешивания испытуемого металла в процессе выдержки при заданной температуре;
2. Путем периодического нагрева образцов, выдерживания их в течение определенного времени при заданной температуре и охлаждения до нормальной температуры с последующим взвешиванием.
Наиболее точные результаты дает первый метод. Однако если учесть то обстоятельство, что в практике оборудование часто эксплуатируется в условиях непрерывной смены температур (например, оборудование печей конвейерного типа), второй метод исследования также представляет интерес.
Скорость газовой коррозии определяется по изменению веса (обычно по привесу) в единицу времени, выраженному в г/л * ч. Эта величина не может оставаться постоянной, если окисление идет по параболическом)' или логарифмическому законам. Поэтому для определения закона окисления необходимо произвести аналитическое исследование полученных экспериментальных данных.
Перед проведением работ необходимо ознакомится:
1. с составом и структурой окисления плёнок;
2. с механизмом роста окисления плёнок;
3. с влиянием легирующих добавок на повышение жаростойкости
4. с влиянием температуры на жаростойкость
5. с методами испытания на газовую коррозию
Выполнение работы
Принадлежности к работе:
Образцы Сu или сталь Ст20 – 9 образцов размера 30х20х5мм
Тигельная печь
Термопара
Гальванометр
Весы с нихромовой нитью
Разновес
Ацетон, вата
Масштабная линейка
Проведение работы
Работу проводят на установке для непрерывного взвешивания образцов (рисунок 12)
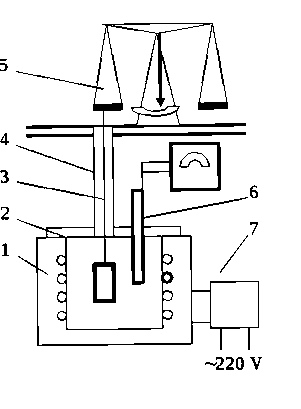
Рисунок 12 Схема установки для непрерывного взвешивания образца. (1-печь; 2 - крышка печи; 3 - нить с образцом; 4 - трубка, внутри которой проходит нить; 5 аналитические весы; 6 - термопара с гальванометром; 7 - автотрансформатор, регулятор температуры).
Вариант 1. Для проведения испытаний используют аналитические весы у которых левая чашка заменена нихромовой проволокой с испытуемым образцом.
1. Испытуемый образец зачищают наждачной бумагой, обезжиривают ацетоном.
2. Площадь поверхности измеряют масштабной линейкой.
3. Образец закрепляют на конце нихромовой проволоки и уравновешивают разновесом, помещённым на чашку весов.
4. Печь предварительно нагревают до требуемой температуры и опускают в неё образец.
5. Температуру печи измеряют термопарой с гальванометром, и регулируют реостатом.
6. Взвешивание через определение интервала времени образец, можно определить изменение веса со временем, т. е. скорость коррозии.
7. Испытание проводят при Т = 500; 600 и 7000С
8. Продолжительность испытания 40 мин.
9. Интервалы между взвешиваниями 10 мин.
10. Запись изменений веса проводят по форме (таблица 14):
Т а б л и ц а14 Форма записи данных
| № образца | Поверхность см2 | Т0С | Изменение веса через, мин. | |||||
|
| 0 | 10 | 20 | 30 | 40 | |||
| 1 | 6 | 500 | ||||||
| 2 | 6 | 600 | ||||||
| 3 | 6 | 700 | ||||||
11.
12. Строят диаграммы:
- зависимости увеличения веса Δ m в мг/см2от продолжительности испытаний;
- зависимости изменений веса в Δ m. мг/см2 за 4 0 мин от температуры.
12. Выполняют анализ полученных диаграмм.
13. Диаграммы строятся в координатах «Изменение веса, мг/см2 – τ» и «Изменение веса, мг/см2 – Т0С».
14 Сделайте выводы по результатам работы
 2020-06-12
2020-06-12 163
163








