Тема: «Азотная кислота»
Это сильная кислота. Бесцветная, концентрированная азотная кислота на воздухе дымит. Очень быстро становится коричневого (бурого) цвета из-за реакции разложения:

4HNO3 = 4NO2 + 2H2O + O2
Азотная кислота — окислитель.
Сырье для производства азотной кислоты – аммиак.
Три последовательные реакции получения азотной кислоты:
1. Каталитическое окисление аммиака:
4NH3+5O2 → кат., t°→ 4NO+6H2
Реакция экзотермическая, необратимая.
2. Окисление NO до NO2:
2NO+O2→2NO2
Реакция экзотермическая, обратимая.
3. Поглощение NO2 водой и одновременно его окисление:
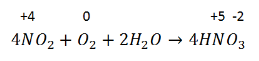
Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
Физические свойства азотной кислоты:
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет, на воздухе дымит.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах.
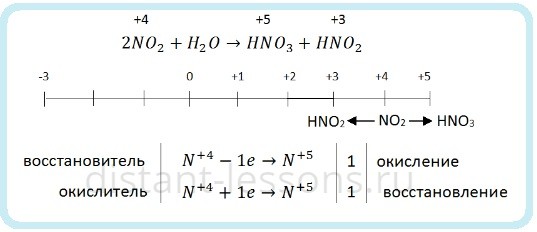
Химические свойства азотной кислоты
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие металлов с азотной кислотой

Примеры взаимодействия металлов различной активности с азотной кислоты различной концентрации:
1. 4Ca + 10HNO3 (разб) → 4Ca(NO3)2 + NH4NO3 + 3H2O
2. Cu + 4HNO3 (конц) → Cu(NO3)2 + 2NO2 ↑+ 2H2O
3. 8Na + 10HNO3 (конц) → 8NaNO3 + N2O ↑ + 5H2O
4. 3Cu + 8HNO3 (разб) → 3Cu(NO3)2 + 2NO ↑ + 4H2O
Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная. Чтобы провести реакцию нужно нагреть:
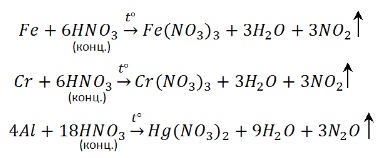
С разбавленной кислотой эти металлы реагируют и без нагревания:
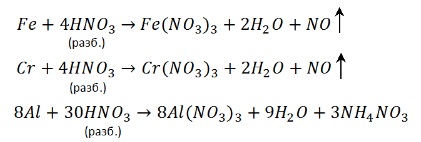
2. Взаимодействие азотной кислоты с неметаллами (C, P, B, S).
Реагирует и концентрированная, и разбавленная азотная кислота.

В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3):
I2 + 10HNO3 конц → t → 2HIO3 + 10NO2 ↑ + 4H2O
3. Взаимодействие с галогенидами – вещества, содержащие F, Cl, Br, I
· HF – слабая кислота, HCl, HBr, HI – сильные кислоты
а) Фтороводород (HF) не реагирует с азотной кислотой, фториды (KF, NaF и др.) реагируют, но без образования газов NO и NO2
KF + HNO3 → HF + KNO3
б) Хлороводород и хлориды металлов (HCl, NaCl и т.д.) вообще не реагируют с азотной кислотой.
в) И только бромиды и иодиды (HBr, HJ, NaBr, NaJ и т.д.) реагируют с азотной кислотой
Азотная кислота восстанавливается до NO2, если концентрированная, разбавленная – до NO

 2020-06-12
2020-06-12 931
931






