II. Окисление NO воздухом
I. Окисление аммиака
ПОЛУЧЕНИЕ АЗОТНОЙ КИСЛОТЫ в промышленности
Взаимодействует с неметаллами
При этом азот обычно восстанавливается до NO или NO2:
S + HNO3(конц) → H2SO4 + NO2 + H2O
S + HNO3(разб) → H2SO4 + NO
P + HNO3(конц) → H3PO4 + NO2 + H2O
P + HNO3(разб) → H3PO4 + NO
C + HNO3(конц) → CO2 + NO2 + H2O
Некоторые органические соединения (например амины, гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности.
NH3 + O2→ NO + H2O Катализатор – платиновая сетка, t = 750 °C
NO + O2→← NO2
III. Поглощение NO2 водой
NO2 + H2O + O2 → HNO3
Полученная кислота имеет концентрацию 40–60 %. Ее перегоняют с серной кислотой – испаряется только HNO3.
Перевозят и хранят разбавленную азотную кислоту в хромированной стали, концентрированную – в алюминиевой таре.
1. В ювелирном деле — основной способ определения золота в золотом сплаве;
2. В производстве минеральных удобрений;
3. В военной промышленности (дымящая — в производстве взрывчатых веществ, как окислитель ракетного топлива, разбавленная — в синтезе различных веществ, в том числе отравляющих);
4. В станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише);
5. В производстве пластмасс, красителей и лекарств (нитроглицерин);
6. Как окислитель в химических синтезах (смесь концентрированной серной и азотной кислот – "нитрующая смесь").
Соли азотной кислоты – НИТРАТЫ Me(NO3)X
Нитраты – белые кристаллические вещества, ВСЕ хорошо растворимы в воде.
Нитраты калия, натрия, кальция, аммония – селитры – используются как удобрения. KNO3, NH4NO3 – в пиротехнике.
Черный порох – это смесь калиевой селитры, древесного угля и серы. Реакция горения черного пороха:
KNO3 + C + S → KNO2 + CO2 + SO2 побочными продуктами являются K2SO4, K2S, K2CO3, CO, N2
При нагревании все нитраты разлагаются. Состав продуктов разложения зависит от положения металла в электрохимическом ряду напряжения:
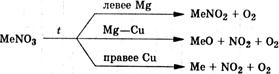
NH4NO3 t→ N2O + H2O взрывается без детонатора
NH4NO3 t→ N2 + H2O + O2 взрывается с детонатором
ФОСФОР P4
 2014-02-09
2014-02-09 4838
4838
