1. Образцы (шлифы) из стали 20, исходные и после работы в коррозийной среде трубопровода.
2. Оптический микроскоп.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1. Расшифровать марку стали, определить содержание углерода.
2. Описать условия работы стали 20 в трубопроводах паровых котлов.
3. Изучить под микроскопом и зарисовать исходную структуру стали 20.
4. Изучить под микроскопом и зарисовать структуру стали 20, подвергнутую коррозии под напряжением.
5. Назначить режим термообработки стали 20 и определить структуру стали после нее.
6. Разработать мероприятия по борьбе с коррозией под напряжением.
7. По результатам работы заполнить табл. 2.
8. Сделать вывод о характере структуры стали 20 и причинах коррозийного растрескивания в трубопроводах.
Таблица 2 - Химический состав, термообработка и микроструктура стали
| Марка стали
| Содержание углерода, %
| Термообработка | Механические свойств
| Микро-структура
| |||||
| Температура нагрева, С | Среда | σт МПа | δ5, % | Ψ, % | KCU, Дж м2 | Исходная т.о | После коррозии | ||
| 20 | |||||||||
КОНТРОЛЬНЫЕ ВОПРОСЫ
1) Что такое коррозия под напряжением?
2) Что такое коррозийное растрескивание под напряжением?
3) Механизм коррозийного растрескивания.
4) Какое напряжение вызывает коррозийное растрескивание? Какая их величина?
5) Какие факторы влияют на коррозийное растрескивание?
6) Что такое межкристаллитное и транскристаллитное коррозийное растрескивание?
7) Какие материалы применяются для теплоэнергетики? Какая их структура?
8) Какие требования предъявляются к материалам, которые работают в теплоэнергетике?
9) Для каких конструкций используется сталь 20?
10)В каких условиях работают трубы в теплоэнергетике?
11)Какие термическая обработка и структура стали 20?
12) Назовите мероприятия, которые уменьшают коррозию под напряжением труб.
ЛАБОРАТОРНАЯ РАБОТА 3
ОПРЕДЕЛЕНИЕ ВЛИЯНИЯ ИНГИБИТОРОВ НА СКОРОСТЬ КОРРОЗИИ
Цель работы: установить количественную оценку действия ингибиторов на скорость коррозийного процесса.
ОБЩИЕ СВЕДЕНИЯ
Большинство коррозийных процессов металлов, которые протекают в электролитах, являются по своей природе электрохимическими. Скорость любого электрохимического коррозийного процесса зависит от скорости двух связанных реакций, которые идут на поверхности металла: анодная, заключается в переходе ионных атомов металла из решетки в раствор и сопровождается освобождением электронов, и катодная, которая заключается в ассимиляции электронов, которые освобождаются при анодной реакции, каким-либо деполяризатором:
пе- М п+→ М п++ пе- (1)
пе-+О х →Red (2)
Ингибиторы могут изменять скорость коррозийного процесса лишь в том случае, если они влияют на кинетику электрохимических реакций, обуславливающих этот процесс.
Классифицируются все ингибиторы на анодные, катодные и смешанные, имея в виду, что первые замедляют преимущественно анодную реакцию, вторые - катодную, а третьи - обе реакции одновременно.
Поскольку ингибиторы изменяют кинетику электрохимических реакций, которые обусловливают коррозийный процесс, механизм ингибирования может быть наиболее полно раскрыт, если установить основные закономерности электрохимической кинетики в присутствии ингибиторов, а также молекулярный механизм их действия. Решению этих двух фундаментальных проблем в сущности и посвящены научные исследования в области ингибиторов коррозии.
Рассмотренные результаты исследований последних лет позволяют классифицировать ингибиторы на неорганические и органические, поскольку механизм их действия существенно различается.
Неорганические ингибиторы, которые в основном применяют в нейтральных электролитах, влияют главным образом на анодный процесс и пассивное состояние металла. Подавление коррозии благодаря изменению лишь кинетики катодной реакции в нейтральных электролитах редко дает ощутимый эффект, если не иметь в виду полное удаление катодного деполяризатора (О2).
Органические ингибиторы, которые применяются в основном в кислых электролитах, в которых стабильность фазовых слоев ниже, действуют по другому механизму. Большое значение здесь имеет адсорбция и влияние, которое она оказывает на кинетику катодной реакции. В кислых электролитах скорость растворения может быть существенно снижена за счет уменьшения скорости катодной реакции, разряда ионов водорода или другого деполяризующего агента, а также удаления из сферы реакции промежуточного продукта реакции восстановления. Однако часто наблюдается определенное влияние ингибиторов и на анодную реакцию.
Деление ингибиторов на органические и неорганические по среде, в которой они применяются (нейтральные, кислые), является несколько условным, в последнее время органические ингибиторы начали применять и в нейтральных, а неорганические - в кислых электролитах. Однако с методической точки зрения такая классификация ингибиторов удобна и часто используется.
Очень часто металлические конструкции, которые находятся в агрессивной среде, невозможно полностью уберечь от коррозии. В этих случаях уменьшение потерь, которые вызываются коррозией, может быть достигнуто с помощью ингибиторной защиты. Для этого в коррозийную среду вводят определенные химические соединения - ингибиторы.
Таким образом, ингибиторами коррозии являются такие химические соединения или смеси нескольких соединений, небольшая добавка которых в коррозийную среду вызывает уменьшение скорости коррозии металла, который находится в среде.
Ингибиторная защита может применяться как самостоятельный метод борьбы с коррозией, а также в сочетании с другими методами. Ингибиторы используются в системах охлаждения двигателей локомотивов, судов, автомобилей, в таких процессах, которые травят металлы, в промышленных транспортирующих трубопроводах.
Во многих случаях для защиты оборудования и металлических конструкций от коррозии можно воспользоваться изменением коррозийной среды, в частности, ограничиться удалением из нее наиболее агрессивных компонентов, ускоряющих процесс коррозии.
Изменение коррозийной среды можно достичь следующими способами:
- удалением кислорода и окислителей с помощью деаэрации раствора, насыщения его азотом или добавления в него поглотителей кислорода;
- удалением кислот и растворенного углекислого газа путем нейтрализации раствора гашеной известью или едким натром;
- удалением солей из воды, которая идет на питание паровых котлов, путем обработки ее ионообменными смолами;
- осушением воздуха с помощью поглотителей влаги, например, силикогеля;
- вакуумированием;
- понижением относительной влажности воздуха в складских помещениях с увеличением его температуры на несколько градусов;
- удалением из воды, воздуха и технологических газов твердых частиц и агрессивных компонентов с помощью фильтрации или абсорбции.
Для снижения концентрации растворенного в воде кислорода используют сульфат натрия и гидразин.
Между гидразином и растворенным кислородом идет реакция:
N2H4 + 02 -> N2 + 2H20 (3)
Этот процесс каталитически ускоряется в присутствии серебра и меди. На 1 л воды тратится - 100 миллиграмм гидразина.
Большинство конструкционных металлических материалов характеризуются малым сопротивлением коррозии в кислой среде (коррозия с водородной деполяризацией). Избыток водородных ионов и растворенный в воде углекислый газ удаляются из раствора при его нейтрализации гашеной известью или едким натром:
Са (ОН)2 + 2Н+ → Са2+ + 2Н20, (4)
Са(ОН)2 + С02 → СаС03 + Н2О (5)
При этом необходимо тщательным образом дозировать нейтрализующие вещество.
С электрохимической точки зрения ингибиторы делятся на катодные, анодные и смешанные. Введение ингибитора вызывает изменение коррозийного потенциала системы и в значительной мере влияет на уменьшение плотности коррозийного тока, который является мерой скорости коррозии металлов.
Замедление коррозии металла можно осуществлять уменьшением скорости катодной реакции, анодной или обеих одновременно. При проведении экспериментов определяется скорость коррозии:
Vкop=Δm/Sτ (6)
где Δm - изменение массы образца при коррозийном процессе, г;
S - площадь поверхности образца, м2;
τ - время, в течение которого образец корродирует, час.
Количественная оценка действия ингибитора на скорость коррозионного процесса характеризуется коэффициентом ингибирования γ или защитным действием Z.
Коэффициентом ингибирования γ называют отношение скорости коррозии металла в среде, которая не содержит ингибитор, к скорости коррозии того же металла после введения в эту среду ингибитора коррозии:
γ=Vкор/Vк.з. (7)
где VKOР - скорость коррозии металла в коррозийной среде, которая не содержит ингибитор, г/м2час;
VК.З - скорость коррозии металла в тех же условиях, но при наличии ингибитора г/м2час..
Защитное действие ингибитора Z, который выражается в процентах, определяется по уравнению:
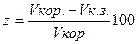 (8)
(8)
Значения величин коэффициента ингибирования и защитного действия ингибитора особенно полезно при сравнении эффективности применения различных ингибиторов.
 2020-06-12
2020-06-12 159
159








