1 Образцы стальные 4 шт.
2 Органический растворитель.
3.Гидразин, 5%- ный H2SO4, Са(ОН)2, шлифовальная бумага.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Оценка действия ингибитора в водопроводной воде
1. Подготовить образцы к проведению эксперимента: обработать шлифовальной бумагой и обезжирить в растворителе.
2. Взвесить на аналитических весах с точностью до ± 0,5.
3. В два химических стакана налить водопроводной воды по 0,5 л.
4. В один стакан прибавить 0,5 г гидразина.
5. Поместить в стаканы приготовленные образцы.
6. Через 30 мин вытащить образцы, осушить и взвесить на аналитических весах. Определить изменение массы образцов Δm.
7. То же повторить через 45 мин, через 60 мин.
8. Определить скорость коррозии металла в коррозийной среде и в среде, которая содержит ингибитор.
9. Рассчитать коэффициенты ингибирования и величину защитного действия ингибитора по формулам (1) и (2).
10. Результаты занести в таблицу. 1.
Таблица 1- Оценка действия ингибитора в водопроводной воде
| Марка стали | Продолжительность опыта, мин. | Изменение массы образца, г | Скорость коррозии в среде без ингибитора, г/м2ч | Скорость коррозии в среде с ингибитором, г/м2ч | Коэффициент ингибирования | Защитное действие ингибитора, % |
Оценка действия ингибитора в кислой среде
1. Подготовить так же как и в первом опыте 2 металлических образца.
2. Образцы взвесить на аналитических весах.
3. В два химических стакана налить по 0,5 л 5%-ной H2SO4.
4. Кислоту нейтрализовать щелочью Са(ОН)2 в одном из стаканов в присутствии фенолфталеина до розовой окраски раствора.
5. Поместить образцы в стаканы.
6. Через 30 мин. вытащить образцы, осушить и взвесить на аналитических весах. Определить изменение массы образцов Δm.
7. То же повторить через 45 мин., через 60 мин.
8. Определить скорость коррозии металла в коррозийной среде и в среде, которая содержит ингибитор.
9. Рассчитать коэффициенты ингибирования и величину защитного действия ингибитора.
10. Результаты занести в табл.2.
11. Сделать выводы о влиянии ингибиторов на скорость процесса коррозии, оценить значение коэффициентов ингибирования и защитное действие ингибиторов в водопроводной воде и кислой среде.
Таблица 2 - Оценка действия ингибитора в кислой среде
| Марка стали | Продолжительность опыта, мин. | Изменение массы образца, г | Скорость коррозии в среде без ингибитора, г/м2ч | Скорость коррозии в среде с ингибитором, г/м2ч | Коэффициент ингибирования | Защитное действие ингибитора, % |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1) Что такое ингибиторы?
2) Где используются ингибиторы?
3) Какие существуют способы изменения коррозийной среды?
4) Какие существуют ингибиторы с электрохимических позиций?
5) Что такое скорость коррозии?
6) Что такое коэффициент ингибирования?
7) Что такое величина защитного действия ингибирования?
8) Как зависит коэффициент ингибирования от скорости коррозии?
9) Как зависит величина защитного действия ингибирования от скорости коррозии?
ЛАБОРАТОРНАЯ РАБОТА 4
ЭЛЕКТРОЛИТИЧЕСКОЕ ЦИНКОВАНИЕ СТАЛИ
Цель работы: получить электролитическим методом цинковое покрытие при заданном режиме с последующим определением качества покрытия, выход металла по току, толщину слоя покрытия.
ОБЩИЕ СВЕДЕНИЯ
В машиностроении широкое применение для защиты деталей и конструкций от коррозии используются металлопокрытия, полученные электролитическим методом, - анодные и катодные.
Потенциал защитного металла анодного покрытия (цинк, кадмий) более электроотрицателен, чем потенциал основного металла, обычно стали. В этом случае сталь защищается от коррозии не только механически, но и электрохимически. Покрытие, будучи анодом, корродирует катодно поляризует и защищает открытые участки стали. Потенциал катодных покрытий (свинец, олово, никель и др.) более положителен, чем потенциал стали. Поэтому сталь разрушаться не будет до тех пор, пока защитный слой остается сплошным, так как катодное покрытие защищает основной металл в активной среде только механически. Однако если металл покрытия является эффективным катодом, например, медное покрытие на нержавеющей стали, то в пассивирующей среде, при отсутствии в них депассиваторов, катодные покрытия анодно поляризуют участки, свободные от покрытия, защищают основной металл и механически, и электрохимически.
Как у анодных, так и у катодных покрытий с увеличением толщины слоя уменьшается пористость, потому толщина слоя является весьма важной характеристикой покрытия.
Пористость покрытия зависит от качества подготовки поверхности образца перед покрытием и от чистоты электролита. Жиры, которые остались на поверхности образца, и оксиды, а также взвешенные частицы в электролите увеличивают пористость покрытия. Чем больше газовыделение на образце в процессе его покрытия, тем больше пор в покрытии.
Электролитический метод нанесения металлического покрытия заключается в электролизе растворов, содержащих соль осаждаемого металла. Анодом служит металл покрытия, катодом – деталь. Под действием постоянного электрического тока, который получается от внешнего источника (аккумулятора, выпрямителя), на катоде происходит разряд положительно заряженных ионов металла из раствора и образование металлопокрытия.
Анод, который растворяется при электролизе, посылает в раствор положительно заряженные ионы металла, поддерживая тем самым постоянство их концентрации.
На рис. 1 показана схема гальванической ванны для нанесения покрытия. Ванна состоит из штанг 1, контактных подвесных крючков 2, анодов 3, стальных образцов 4, вольтметра 5, амперметра 6, реостата 7, рубильника 8.
Количественно электролиз подчиняется закону Фарадея, на основании которого можно определить выход по току, толщину слоя металлопокрытия и время для получения слоя защитного металла заданной толщины.
Электролиз ведут в кислом цинковом растворе при следующем режиме: плотность тока 0,0075-0,0125 а/см2, длительность процесса 30 мин., температура электролита - комнатная.
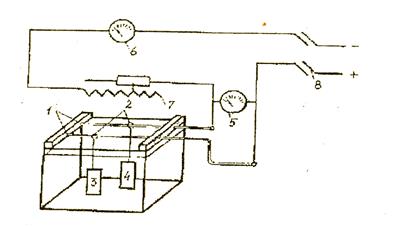
Рис. 1 - Схема установки для получения электролитических покрытий
Величина тока, которая необходима для покрытия детали, определяется по формуле:
I = ik*S, (1)
где ik - плотность, а;
S - полная поверхность всех деталей, которые покрываются, находящихся в электролите, см2.
Толщину слоя покрытия можно определить капельным методом. Для этого применяют раствор, который содержит 200 г KJ и 100 г J2 в одном литре воды. Одна капля раствора в течение одной минуты растворяет при 10°С цинк толщиной 0,78 мкм, при 15°С - 1,01 мкм, при 200С -1,24 мкм, при 25°С - 1,45 мкм.
После нанесения цинкового покрытия определяют средний выход металла по току по формуле %:
ή=m /IτC (2)
где m - масса металла, который выделился, на всех образцах, г;
I - сила тока во время электролиза, а;
τ - длительность электролиза, час.;
С - электрохимический эквивалент осаждаемого металла, равный 1,220 г/а.час.
Толщину слоя покрытия можно определить расчетным методом по формуле, мкм:
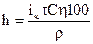 (3)
(3)
где ρ - плотность цинка равна 7,14 г/см3.
 2020-06-12
2020-06-12 117
117








