Состояние динамического равновесия в растворах электролитов, при котором скорость диссоциации молекул растворенного вещества на ионы равна скорости ассоциации ионов в молекулы, характеризуется константой диссоциации, обозначаемой 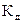 .
.
Для состояния равновесия
| (2.1)
|
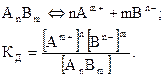
Величина 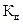 зависит только от температуры и природы веществ.
зависит только от температуры и природы веществ.
Если каждая молекула при диссоциации образует один катион и один анион (n = m = 1) то концентрации катионов и анионов, находящихся в растворе, равны [A+] =[B-]= С0∙α, где С0 — первоначальная концентрация вещества; α — степень диссоциации, представляющая собой, как сказано выше, долю молекул, распавшихся на ионы.
Число оставшихся после диссоциации непродиссоциировавших молекул [AB] = Сo - С0∙α = С0 ∙(I - α).
В этом случае значение константы диссоциации:
| (2.2)
|
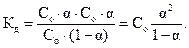
Формула (2.2) представляет собой математическое выражение закона разведения Оствальда. Если α«1 (раствор очень слабого электролита), то в знаменателе ее величиной по сравнению с единицей можно пренебречь. Тогда
| (2.3)
|
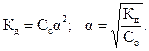
Полученное выражение наглядно показывает, что степень диссоциации с ростом концентрации раствора уменьшается. Величина константы диссоциации определяет силу электролитов. Различают очень слабые электролиты, для которых 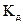 < 1O-7. Для просто слабых электролитов константа диссоциации лежит в интервале 1O-7 <
< 1O-7. Для просто слабых электролитов константа диссоциации лежит в интервале 1O-7 < 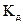 < 1O-2, а для сильных и очень сильных соответственно 1O-2 <
< 1O-2, а для сильных и очень сильных соответственно 1O-2 < 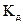 < 1О3 и
< 1О3 и
1O3 < 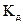 < 1О8.
< 1О8.
Ионное произведение воды. Кислотность растворов.
 2020-06-08
2020-06-08 377
377








