Экспериментальным путем (Рауль, 1887 г.) установлено, что давление пара растворителя над раствором ниже, чем над чистым растворителем и «относительное понижение давления насыщенного пара над раствором Δрравно мольной доле растворенного нелетучего вещества» (закон Рауля):
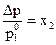 , (1.1)
, (1.1)
где 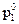 — давление насыщенного пара чистого растворителя;
— давление насыщенного пара чистого растворителя; 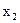 — мольная доля растворенного нелетучего вещества.
— мольная доля растворенного нелетучего вещества.
Закон Рауля справедлив для идеальных или бесконечно разбавленных растворов неэлектролитов (веществ, не распадающихся на ионы под действием полярных молекул растворителя). Из этого закона следует, что температура кипения разбавленного раствора, содержащего нелетучее растворенное вещество, выше, а температура замерзания соответственно ниже температуры кипения и замерзания чистого растворителя. Это следствие можно сформулировать так: «Повышение температуры кипения и понижение температуры замерзания раствора прямо пропорционально моляльной концентрации растворенного вещества»:
| (1.2) |
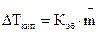 ;
; 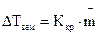 ,
,
где 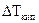 – повышение температуры кипения раствора;
– повышение температуры кипения раствора; 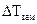 – понижение температуры замерзания раствора;
– понижение температуры замерзания раствора; 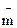 — моляльность раствора;
— моляльность раствора; 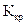 – криоскопическая постоянная;
– криоскопическая постоянная; 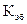 –
–  эбуллиоскопическая постоянная.
эбуллиоскопическая постоянная.
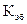 и
и 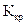 зависят только от природы растворителя. Их величины приводятся в справочниках. Например, для воды
зависят только от природы растворителя. Их величины приводятся в справочниках. Например, для воды 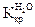 = 1,86о,
= 1,86о, 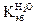 = 0,52о для бензола
= 0,52о для бензола 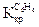 = 4,90о,
= 4,90о, 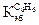 = 2,65о.
= 2,65о.
Измерение как разности температур замерзания 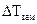 (криоскопия), так и разности температур кипения
(криоскопия), так и разности температур кипения 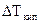 (эбулиоскопия) раствора и чистого растворителя дает способ экспериментального определения молярной массы неэлектролита. Для этого навеску в граммаx
(эбулиоскопия) раствора и чистого растворителя дает способ экспериментального определения молярной массы неэлектролита. Для этого навеску в граммаx  вещества с неизвестной молярной массой М2, содержащей
вещества с неизвестной молярной массой М2, содержащей 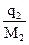 молей растворенного вещества, растворяют в известном количестве растворителя
молей растворенного вещества, растворяют в известном количестве растворителя 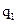 и измеряют повышение температуры кипения или понижение температуры замерзания:
и измеряют повышение температуры кипения или понижение температуры замерзания:
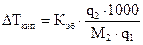
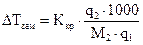 , (1.3)
, (1.3) 
Моляльность Моляльность
раствора раствора
отсюда
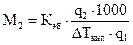 , или
, или 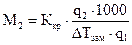 . (1.4)
. (1.4)
Для электролитов в закон Рауля вводится поправка — изотонический коэффициент i, который показывает, во сколько раз возрастает число частиц в растворе вследствие диссоциации электролита:
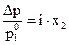 . (1.5)
. (1.5)
Поэтому для растворов электролитов:
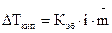
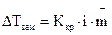 . (1.6)
. (1.6)
Изотонический коэффициент связан со степенью диссоциации α, которая представляет собой отношение числа продиссоциировавших молекул N к первоначальному числу N0:
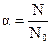 . (1.7)
. (1.7)
Очевидно, что число продиссоциировавших молекул N будет равно N0α, а величина [N0 - N0α = N0 (I — α)] определит число непродиссоциировавших молекул.
Общее же число частиц в растворе будет равно [ 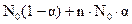 ], где n – суммарное число ионов, на которое распадается одна молекула электролита.
], где n – суммарное число ионов, на которое распадается одна молекула электролита.
Изотонический коэффициент, таким образом, представляет собой отношение
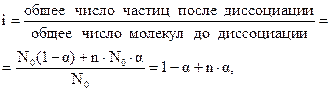
откуда степень диссоциации 
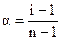 . (1.7 а)
. (1.7 а)
По этому уравнению можно рассчитать степень диссоциации электролита, зная изотонический коэффициент, который в свою очередь определяется экспериментально как отношение полученного опытным путем значения свойства раствора, например 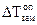 к теоретическому (расчетному) значению:
к теоретическому (расчетному) значению:
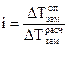 , (1.7 б)
, (1.7 б)
следовательно:
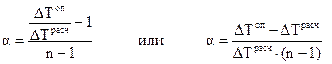 . (1.8)
. (1.8)
 2020-06-08
2020-06-08 338
338








