Федеральное агентство по образованию
__________________
МОСКОВСКИЙ АВИАЦИОННЫЙ ИНСТИТУТ
(ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ)
____________________________________________________
РАСТВОРЫ. ЭЛЕКТРОХИМИЯ
Учебное пособие к лабораторному практикуму по химии
Утверждено
на заседании редсовета
17 октября 2007 г.
М О С К В А
Издательство МАИ−ПРИНТ
2 0 0 9
Авторы:
Н.А. Бункина, Н.С. Буданова, В.Н. Гразлов, С. И. Селиванова, М. А. Семенова, В. А. Новожилов, А. А. Фармаковская, Н. П. Жарова, Г. Н. Устюжанинова.
РАСТВОРЫ. ЭЛЕКТРОХИМИЯ
Учебное пособие к лабораторному практикуму по химии/
/ Под редакцией Н.С. Будановой и А.А. Фармаковской –
М.: Изд-во МАИ-ПРИНТ, 2009, с:, ил.
УДК:54+541.8+541.13] (076)
Пособие содержит теоретическое введение и описание лабораторных работ по двум основным разделам курса химии: «Растворы» и «Электрохимия». В разделе «Растворы» рассмотрены вопросы равновесия в растворах неэлектролитов и электролитов, буферные растворы, коллоидные растворы, адсорбционное равновесие, ионообменная хроматография. Раздел «Электрохимия» посвящен вопросам, связанным с теорией гальванических элементов, электролиза, коррозии, а также практическим применениям электрохимических методов анализа.
Пособие предназначено для студентов 1-го курса всех технических факультетов МАИ дневной и вечерней форм обучения.
Рецензенты:
кафедра физики и физической химии Военно-инженерной академии
им. Н.Е. Жуковского (зав. кафедрой профессор В.В. Чернышев);
д-р х. н., профессор Н.Н. Желиговская.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
РАЗДЕЛ 1. РАСТВОРЫ
В окружающем нас мире практически все жидкости – это растворы.
Растворы (жидкие, твердые или газообразные) представляют собой гомогенную (однородную) систему из двух или большего числа веществ (компонентов), равномерно распределенных друг в друге. При растворении одного компонента в другом или смеси других происходит изменение качественного и количественного состава растворов. Поэтому кратко раствор можно определить как многокомпонентную гомогенную систему переменного состава. Составными частями раствора являются растворитель (вещество, которое находится в избытке по сравнению с остальными веществами) и растворенные вещества. По концентрации растворенного вещества растворы принято делить на ненасыщенные, насыщенные и пересыщенные.
Для характеристики количественного состава раствора при химических экспериментах чаще всего используются следующие концентрации:
1) массовые проценты — число массовых частей растворенного вещества в 100 массовых частях раствора, %;
2) молярность М — число молей растворенного вещества в 1 л раствора [г-моль/л];
3) нормальность N — число грамм-эквивалентов растворенного вещества в 1 л раствора [г-экв/л];
4) моляльность 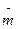 — число молей растворенного вещества в 1000 г растворителя [г-моль/кг растворителя];
— число молей растворенного вещества в 1000 г растворителя [г-моль/кг растворителя];
5) титр Т — число граммов растворенного вещества в 1 см3 (мл) раствора [г/см3];
6) мольная доля — отношение числа молей растворенного вещества к сумме числа молей всех компонентов раствора 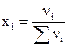 .
.
Глава 1.
 2020-06-08
2020-06-08 628
628







