Атомная орбиталь - состояние электрона в атоме. Условное обозначение орбитали -  . Каждой орбитали соответствует электронное облако.
. Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s, p, d и f.
Электронное облако - часть пространства, в которой электрон можно обнаружить с вероятностью 90 (или более) процентов.
Примечание: иногда понятия "атомная орбиталь" и "электронное облако" не различают, называя и то, и другое "атомной орбиталью".
Электронная оболочка атома слоистая. Электронный слой образован электронными облаками одинакового размера. Орбитали одного слоя образуют электронный ("энергетический") уровень, их энергии одинаковы у атома водорода, но различаются у других атомов.
Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни:
s -подуровень (состоит из одной s -орбитали), условное обозначение -  .
.
p -подуровень (состоит из трех p -орбиталей), условное обозначение - 

 .
.
d -подуровень (состоит из пяти d -орбиталей), условное обозначение - 



 .
.
f -подуровень (состоит из семи f -орбиталей), условное обозначение - 





 .
.
Энергии орбиталей одного подуровня одинаковы.
При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2 s, 3 p, 5 d означает s -подуровень второго уровня, p -подуровень третьего уровня, d -подуровень пятого уровня.
Общее число подуровней на одном уровне равно номеру уровня n. Общее число орбиталей на одном уровне равно n 2. Соответственно этому, общее число облаков в одном слое равно также n 2.
Обозначения:  - свободная орбиталь (без электронов),
- свободная орбиталь (без электронов),  - орбиталь с неспаренным электроном,
- орбиталь с неспаренным электроном,  - орбиталь с электронной парой (с двумя электронами).
- орбиталь с электронной парой (с двумя электронами).
Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно):
1. Принцип наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии орбиталей.
2. Принцип Паули - на одной орбитали не может быть больше двух электронов.
3. Правило Хунда - в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
Общее число электронов на электронном уровне (или в электронном слое) равно 2 n 2.
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1 s, 2 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s, 4 d, 5 p, 6 s, 4 f, 5 d, 6 p, 7 s, 5 f, 6 d, 7 p...
Наглядно эта последовательность выражается энергетической диаграммой:
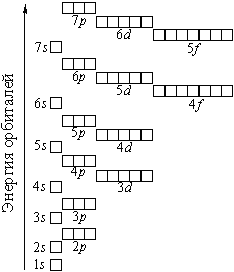
Распределение электронов атома по уровням, подуровням и орбиталям (электронная конфигурация атома) может быть изображена в виде электронной формулы, энергетической диаграммы или, упрощенно, в виде схемы электронных слоев ("электронная схема").
Примеры электронного строения атомов:
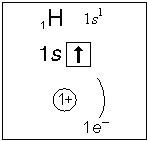
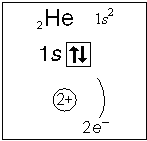
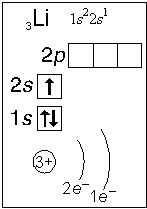
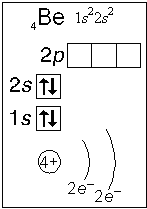
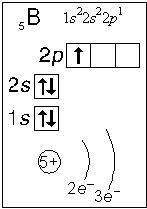
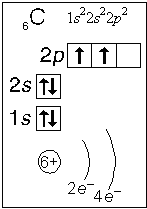
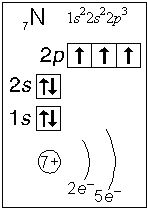
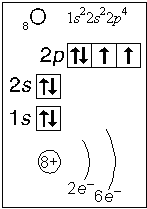
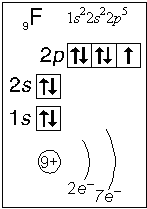
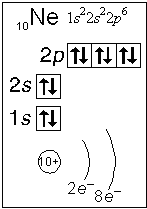
Валентные электроны - электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны - 4 s 2, они же и валентные; у атома Fe внешние электроны - 4 s 2, но у него есть 3 d 6, следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция - 4 s 2, а атома железа - 4 s 23 d 6.
3. Обобщение материала. Решение задач.
1. Составить в молекулярном и ионном виде уравнения реакций по схеме:
C → CO2 → CaCO3 → CaO
1) C + O2 = CO2
2) CO2 + CaO = CaCO3
3) CaCO3 (нагреть) = CaO + CO2
2. Вычислите массу металла, полученного восстановлением водородом из оксида меди (II) массой 16 г.
| Дано: m (CuO) = 16 г | Решение: CuO + H2 = Cu + H2O Находим молекулярную массу CuO Mr (CuO) = 64 +16 = 80 г Составляем пропорцию. 80: 16 = 64: Х Находим Х Х = 16 х 64 / 80 Х = 12.4 Ответ: масса меди 12.4 гр. |
| Найти: M (Cu) =? |
3. Вычислите массу метана в составе природного газа объемом 300 л. (н.у) Концентрация 60%
| Дано: V(прир.газа) = 300л С(СН4) = 60% | Решение: VM = 22.4 л/моль Вычисляем объем метана в составе природного газа. 300 х 60: 100 = 180 л Находим количество вещества, соответствующего 180 л. метана учитывая нормальные условия. 180 х 22.4 л/моль = 8 моль Mr (CH4) = 12 +4 = 16г Находим массу метана. m (CH4) = 16 х 8 = 128 гр. Ответ: масса метана = 128 гр.
|
| Найти: m (CH4) =? ну |
4. Домашнее задание.
Рассчитать количество протонов, нейтронов, электронов в ядрах атомов – Cu, Fe, Au.
5. Литература Учебник Химия 10 класс О.С. Габриелян И.Г. Остроумов, С.А. Сладков Москва, «Просвещение». 2018 г параграф 11-19
 2020-06-08
2020-06-08 154
154







