Тема: Подготовка к экзамену.
Форма работы: индивидуальная, электронное обучение.
Урок повторения и обобщения знаний.
Цель: повторить строение атома, периодическую систему, периодический закон.
Основные понятия: протоны, нейтроны, электроны, периоды, группы, подгруппы.
Используемая литература:
Учебник Химия 10 класс О.С. Габриелян И.Г. Остроумов, С.А. Сладков Москва, «Просвещение». 2018 г
Интернет-ресурсы:
Ход урока.
1. Организационная часть.
Вспомним устройство периодической системы, как изменяются свойства элементов в периодической системе. Какое строение имеют атомы элементов и как по периодической системе узнать количество протонов, нейтронов и электронов в ядрах атомов.
2. Основная часть.
Периодическая система химических элементов.
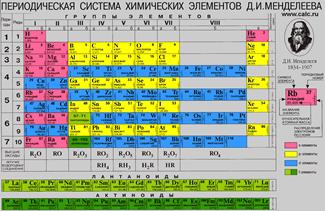
Рис. 2. "Короткая форма"

Рис. 3. Клеточка таблицы
Каждая клеточка Периодической системы содержит символ одного химического элемента, у которого указан порядковый номер и значения относительной атомной массы элемента. Рис. 3.
Период начинается щелочным металлом и заканчивается инертным газом.
Всего периодов семь. Исключением является 1-ый период. В его состав входит только 2 химических элемента: водород, который не считается щелочным металлом, и гелий.
ый, 2-ой, 3-ий периоды называются малыми. Они содержат 2 и 8 химических элементов и состоят из одного ряда.
4-7 периоды называются большими. 4-ый и 5-ый периоды включают в себя 18 элементов. 6-ой и 7-й состоят из 32 элементов. В 6-ом и 7-ом периодах есть группы, состоящие из 14 элементов. В 6-ом периоде эти элементы схожи по свойствам с лантаном, а в 7-ом – с актинием. Эти элементы вынесены за основную таблицу и называются лантаноиды и актиноиды. Они обладают одинаковыми свойствами.
Группой называется вертикальный ряд химических элементов. Все элементы группы имеют одинаковое число валентных электронов.
Группы в короткой форме таблицы делятся на главную «А» и побочную «Б» подгруппы.
В каждой главной подгруппе с ростом порядкового номера элемента химические свойства меняются от неметаллических на металлические.
В побочную подгруппу включаются только металлы, называемые переходными элементами.
Если подгруппа начинается элементами малого периода – это главная подгруппа. Подгруппа, которая начинается элементами большого периода, – это побочная подгруппа. Например, рассмотрим II группу периодической системы. Рис. 4.
Бериллий Be – элемент 2-го периода.
Он начинает столбик элементов главной подгруппы. В её состав входят: Be. Mg, Ca, Sr, Ba, Ra.
Цинк Zn начинает побочную подгруппу, так как он входит в состав 4-го периода. В побочную подгруппу входит Zn, Cd, Hg.
Это отражается в названии некоторых групп элементов.
- Например, элементы главной подгруппы 1-ой группы – Li, Na, K, Rb, Cs, Fr – называются щелочные металлы.
- Элементы главной подгруппы 2-ой группы – Ca, Sr, Ba, Ra – называются щелочноземельные металлы.
- Халькогены O, S, Se, Te, Po – элементы 6-й группы главной подгруппы.
- Галогены: F, Cl, Br, J, At – элементы 7-й группы главной подгруппы.
- 8-ю главную подгруппу называют подгруппой инертных или благородных газов. Это He, Ne, Ar, Kr, Xe, Ra.
Химические свойства в периодах меняются с металлических через амфотерные на неметаллические. Таким образом, зная химические свойства элемента, можно предположить, где конкретно он находится в Периодической системе. И наоборот, если знать положение элемента в Периодической системе, можно предположить его химические свойства.
Состав атома.
Атом состоит из атомного ядра и электронной оболочки.
Ядро атома состоит из протонов (p+) и нейтронов (n 0). У большинства атомов водорода ядро состоит из одного протона.
Число протонов N (p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов).
N (p +) = Z
Сумма числа нейтронов N (n 0), обозначаемого просто буквой N, и числа протонов Z называется массовым числом и обозначается буквой А.
A = Z + N
Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е -).
Число электронов N (e -) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
Масса протона примерно равна массе нейтрона и в 1840 раз больше массы электрона, поэтому масса атома практически равна массе ядра.
Форма атома - сферическая. Радиус ядра примерно в 100000 раз меньше радиуса атома.
Химический элемент - вид атомов (совокупность атомов) с одинаковым зарядом ядра (с одинаковым числом протонов в ядре).
Изотоп - совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.
Обозначение отдельного атома или изотопа: 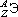 (Э - символ элемента), например:
(Э - символ элемента), например: 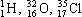 .
.
 2020-06-08
2020-06-08 93
93







