Проводящие измерения начались еще в XVIII веке, когда Андреас Баумгартнер заметил, что соленые и минеральные воды из Бад-Гаштайна в Австрии проводят электричество. Таким образом, использование этого метода для определения чистоты воды, которая часто используется сегодня для проверки эффективности систем очистки воды, началось в 1776 году. Так и началась история кондуктометрического метода анализа.
Фридрих Кольрауш продолжил развитие этой науки в 1860 годах, когда применил переменный ток к воде, кислотам и другим растворам. Примерно в это же время Уиллис Уитни, который изучал взаимодействия комплексов серной кислоты и сульфата хрома, нашел первую кондуктометрическую конечную точку. Эти находки завершились потенциометрическим титрованием и первым инструментом для объемного анализа Робертом Берендом в 1883 году при титровании хлорида и бромида HgNO3. Таким образом, современный кондуктометрический метод анализа основан Берендом
Кондуктометрический метод анализа основан на измерении электрической проводимости растворов и установления зависимости ее от концентрации.
Метод применим для определения концентрации растворов солей, кислот, оснований, для контроля состава промышленных растворов.
Методы анализа:
-прямая кондуктометрия
-низкочастотное кондуктометрическое титрование
-высокочастотное кондуктометрическое титрование
· Теоретические основы метода
Проводники электрического тока делятся:
-проводники 1 рода - это металлы, обладающие электронной проводимостью
- проводники 2 рода – это электролиты, обладающие ионной проводимостью
Электролиты – это вещества, молекулы или кристаллы которых распадаются на ионы, под воздействием молекул растворителя или высокой температуры (диссоциация)
В кондуктометрии рассматриваются именно проводники второго рода.
Для электролитов, также, как для металлов справедлив закон Ома:
· сила тока в проводнике прямо пропорциональна напряжению на его концах (разности потенциалов) и обратно пропорциональна сопротивлению этого проводника.
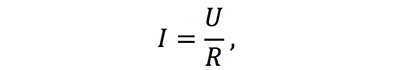
Где: I-сила тока,А
U-разность потенциалов между электродами,В
R-сопротивление проводника, Ом
Основной константой, характеризующей электрические свойства веществ, является электрическое сопротивление
R = p 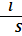 ,
,
где:
l-длина (расстояние между электродами),м
S- площадь сечения проводника,м2,см2
p-удельное сопротивление,Ом*см/см2 Удельным сопротивлением называется сопротивление столба исследуемого вещества длиной в 1 см и площадью сечения 1 см2
Единица измерения электрической проводимости- сименс,См
1 сименс - это электрическая проводимость проводника, между концами которого создается
напряжение 1В при силе тока 1А
Электрическая проводимость (W) – величина, обратная электрическому сопротивлению проводника (R)
W = 
Величина, обратная удельномуэлектрическому сопротивлению, называется удельной
электрической проводимостью
Удельная электрическая проводимость равна электрической проводимости 1 м3 раствора, находящегося между параллельными электродами площадью 1 м2при расстоянием между ними 1м.

Для характеристики качественных и количественных характеристик растворов применяют эквивалентную электропроводность
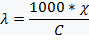
Эквивалентной электропроводностью называется электрическая проводимость раствора электролита толщиной 1 м, находящегося между одинаковыми электродами с такой площадью, чтобы объем жидкости, заключенный между ними, содержал 1 моль химического эквивалента растворенного вещества.
Эквивалентная электропроводность измеряется в См ∙ моль–1 ∙ м2 или Ом–1 ∙ моль–1 ∙ м2. В справочной литературе эквивалентную электропроводность часто приводят в единицах измерения См ∙ моль–1 ∙ см2 или Ом–1 ∙ моль–1 ∙ см2. (При этом удельная электропроводность ϰ выражается в Ом–1 ∙ см–1 или См ∙ см–1, С- молярная концентрация эквивалента в моль/см3).
· Закон Кольрауша
В бесконечно разбавленном растворе эквивалентная электропроводность достигает предела и не зависит от концентрации, т.к в растворах слабых электролитов наступает полная диссоциация (α==1), в растворах сильных электролитов исчезает межионное взаимодействие
Эквивалентная электропроводность бесконечно разбавленных растворов (λ∞) называется предельной электропроводностью
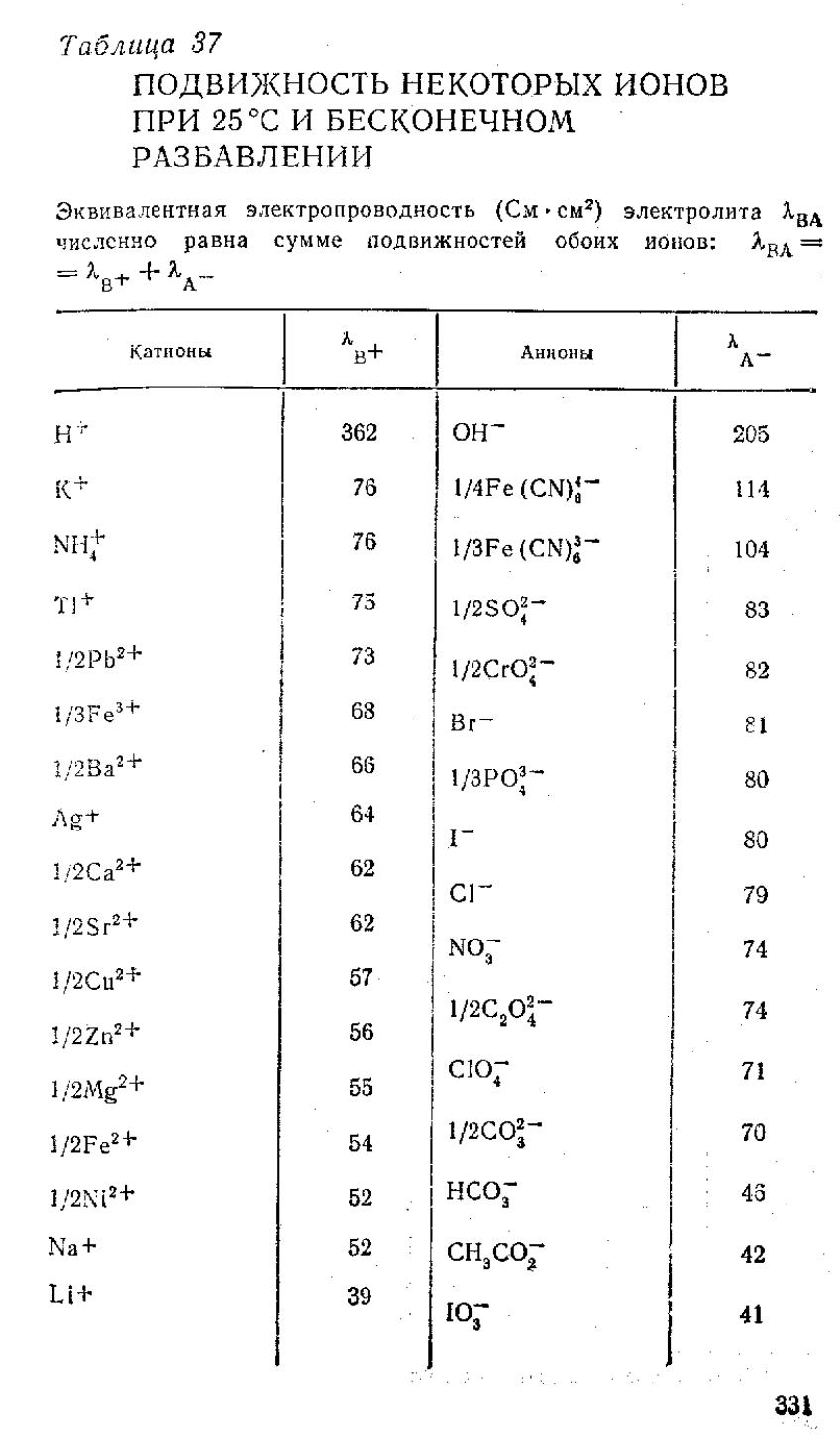
Кольрауш установил, что при таком разведении катионы и анионы проводят электричество независимо друг от друга, т.к. силы взаимодействия между ними отсутствуют. В этом случае эквивалентная электропроводность раствора будет равна сумме электропроводностей катионов (λк) и анионов (λа)
λ∞ = λк + λа
На основании этого закона можно рассчитать любого раствора с известной концентрацией
Значения подвижностей ионов приводятся в справочной литературе
Электропроводность раствора зависит:
-от природы вещества
-природы растворителя
-температуры
-концентрации
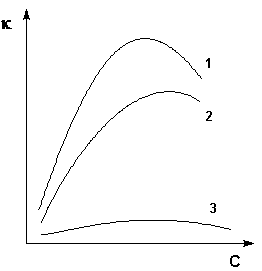
Зависимость удельной электропроводности электролитов от концентрации
(1 – H2SO4, 2 – KOH, 3 – CH3COOH)
По величине эквивалентной электропроводности можно рассчитать:
-константу диссоциации
-растворимость веществ и другие величины
· Измерение электропроводности
Аппаратурой для измерения сопротивления и следовательно электропроводности является мостовая схема Уитстона на приборе Кольрауша
Приборы для измерения электропроводности - кондуктометры
Принцип действия этих приборов основан на измерении электропроводимости анализируемых растворов, т. е. на кондуктометрическом методе. Применяются измерительные ячейки, состоящие из двух электродов, помещенных в анализируемый раствор на определенном расстоянии друг от друга. Сопротивление ячейки определяется только электропроводимостью раствора. 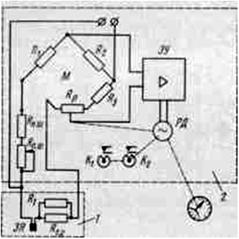
Принципиальная схема кондуктомера
Прибор состоит из двух основных узлов: преобразователя (1) и измерительного устройства (2).
Преобразователь включает электрохимическую ячейку ЭЯ, температурно-компенсирующее сопротивление Rt. с и шунтирующее сопротивление RT, служащее для настройки схемы.
Измерительное устройство- уравновешенный мост переменного тока - включает мостовую схему М, электронный усилитель ЭУ и реверсивный двигатель РД, воздействующий на движок реохорда Rv.
Сопротивления RH.ш и Rn. ш служат для настройки в процессе работы. Действует прибор следующим образом. Изменение концентрации раствора вызывает изменение сопротивления между электродами измерительной ячейки ЭЯ, что приводит к разбалансу моста, и на входе усилителя появляется сигнал, пропорциональный изменению концентрации раствора. Усиленный сигнал воздействует на реверсивный двигатель РД, перемещающий движок реохорда в направлении ликвидации разбаланса. Контакты К1 и К2 сигнализируют о максимальном и минимальном значении концентрации раствора.
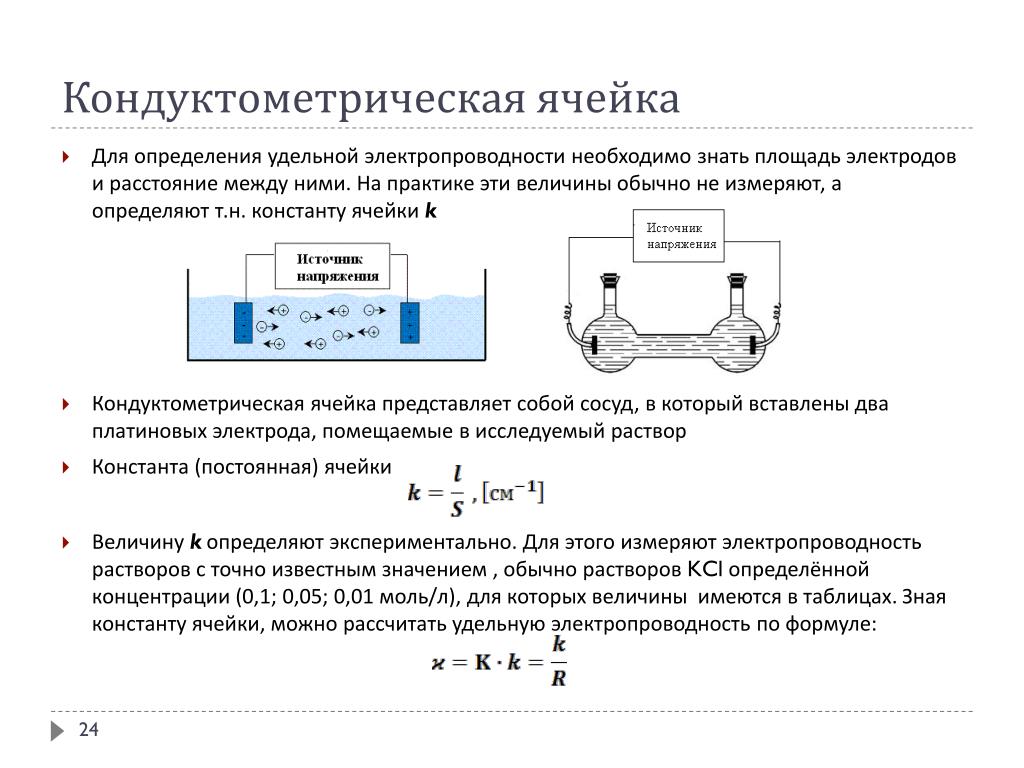


Кондуктометрические ячейки
· Методы кондуктометрии
 2020-06-08
2020-06-08 4585
4585