Особенностями строения бензольного кольца объясняется отличие химических свойств аренов от предельных и непредельных углеводородов. Делокализация шести π-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов. Для аренов более характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атомов водорода, связанных с циклом.
Наличие областей повышенной электронной плотности с двух сторон плоского ароматического цикла ведет к тому, что бензольное кольцо является нуклеофилом и в связи с этим склонно подвергаться атаке электрофильным реагентом. Таким образом, для ароматических соединений наиболее типичны реакции электрофильного замещения.
Для аренов возможны и другие реакции (присоединение, окисление). В них участвуют делокализованные углерод-углеродные связи бензольного кольца и нарушается его ароматичность, поэтому они протекают с трудом, при особых условиях.
Примеры реакций электрофильного замещения в бензоле:
1. Галогенирование
Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3 и т.п. (кислот Льюиса):
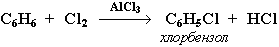
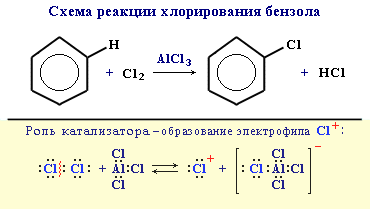
2. Нитрование
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
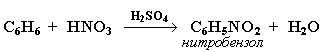
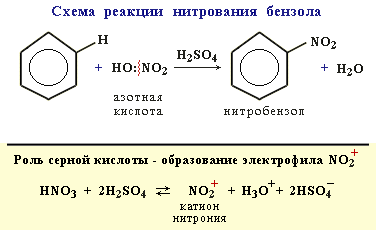
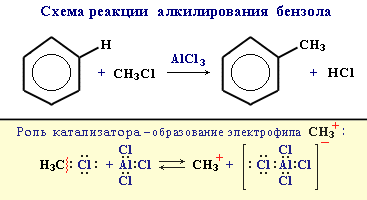
3. Алкилирование
Замещение атома водорода в бензольном кольце на алкильную группу(алкилирование) происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса).
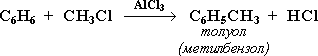
 2020-06-08
2020-06-08 120
120








