Пример 1. Рассчитайте Kг, hг, pH 0,01М раствора гипохлорита натрия. Кα(HClO) = 2,95 · 10–8.
Решение:
Гипохлорит натрия — соль образована сильным основанием NaOH и слабой кислотой HClO, следовательно, она подвергается гидролизу по аниону.
1. Запишем уравнение гидролиза: ClO– + H2O ↔ HClO + OH–.
2. Рассчитаем константу гидролиза: 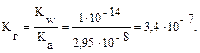
3. Определим степень гидролиза соли:

4. Найдем концентрацию ОН–: из уравнения реакции гидролиза видно, что [HClO] = [OH–]
 [OH–] = hr · C(NaClO) = 5,8 · 10–3∙10-2=5,8∙10-5;
[OH–] = hr · C(NaClO) = 5,8 · 10–3∙10-2=5,8∙10-5;
pOH = – lg(5,8 · 10–5) = 4,23;
pH = 14 – 4,25 = 9,77.
Применив расчетную формулу, также можно вычислить рН данного раствора:
рН = 7 – ½ lg (2,95 · 10–8) +1/2 lg10–2 = 7 + 3,77 – 1 = 9,77.
Пример 2. рН раствора ацетата натрия CH3COONa равно 9,50. Рассчитайте См, Kг, hг соли.
Кα(CH3COOН) = 1,76 · 10–5.
Решение:
Соль ацетат натрия образована сильным основанием NaOH и слабой кислотой CH3COOН, следовательно, гидролизу подвергается по аниону.
1. Запишем уравнение гидролиза:
CH3COO– + Н2О ↔ CH3COOН + ОН–.
2. Определим концентрацию соли, используя значение рН данного раствора:
 обозначим [CH3COONa] = х моль/л,
обозначим [CH3COONa] = х моль/л,
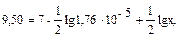 0,24 = lgx, x = 1,74 моль/л.
0,24 = lgx, x = 1,74 моль/л.
 моль/л.
моль/л.
3. Рассчитаем константу и степень гидролиза:




Пример 3. Вычислите рН раствора, полученного при растворении 5,35 г хлорида аммония в 1 л H2O. Kв(NH3∙Н2О) = 1,75 · 10–5.
Решение:
Хлорид аммония — соль, образованная сильной кислотой HCl и слабым основанием NH3∙Н2О, следовательно, гидролизуется по катиону.
1. Запишем уравнение гидролиза в ионной форме:
NH4+ + H2O Û NH3 + H3O+.
2. Рассчитаем молярную концентрацию хлорида аммония:


3. Находим концентрацию катионов водорода:


рН = –lg7,56 · 10–6 = 5,10.
Пример 4. Вычислите степень гидролиза и константу гидролиза бромида аммония в 0,10М растворе, рН которого равен 5.
Кв = 1,75 · 10–5.
Решение:
1. Запишем ионное уравнение гидролиза: NH4+ + H2O ↔ NH3 + H3O+.
2. Определим концентрацию ионов водорода в растворе соли:
рН = 5,00; [H+] = 10–5 моль/л.
3. Рассчитаем степень гидролиза бромида аммония:
[NH3] = [H+], тогда hг = 
4. Константу гидролиза рассчитаем согласно уравнении.

Зная константу ионизации слабого электролита и ионное произведение воды, запишем:


Пример 5. Рассчитайте константу диссоциации (Кα) азотистой кислоты, если концентрация раствора нитрита калия равна 1 · 10–3 моль/л, рН раствора соли равен 7,15.
Решение:
1. Запишем уравнение гидролиза: NO2– + H2O Û HNO2 + OH–.
2. [HNO2] = [OH–], 
 следовательно?
следовательно?

 (I)?
(I)?
3. Среда раствора при гидролизе этой соли определяется наличием в растворе гидроксильных групп. рН + рОН = 14, тогда рОН = 14 – рН, рОН = 14 – 7,15 = 6,85, рОН = –lg[OH–] [OH–] = 1,4 · 10–7 моль/л.
4. Рассчитаем константу диссоциации слабого протолита (HNO2); подставить в формулу (I) численные значения.

Пример 6. Во сколько раз надо изменить концентрацию 0,1М раствора ацетата натрия (CH3COONa), чтобы степень гидролиза соли удвоилась?
Решение:
Степень гидролиза любого растворенного вещества увеличивается при уменьшении концентрации раствора, значит, раствор следует разбавить, добавив воды.

При уменьшении концентрации Сс в х раз степень гидролиза увеличивается в  раз Û чтобы hr удвоилась, раствор нужно разбавить в 4 раза.
раз Û чтобы hr удвоилась, раствор нужно разбавить в 4 раза.
Пример 7. Оцените рН 1,0М раствора гидросульфита калия (KHSO3).
Решение:
1. Гидросульфит калия в растворе полностью диссоциирован на ионы:
KHSO3 → К+ + HSO3–. KI = 1,6 ·10-2
2. Ионы HSO3– участвуют в двух равновесиях:
— диссоциации по второй ступени: HSO3– + H2O Û Н3О+ + SO32–,
КII = 6 · 10–8;
—гидролиза: HSO3– + H2O Û H2SO3 + OH–, 
Если Кll > Kr, то реакция среды практически полностью определяется равновесием диссоциации иона HSO3–.
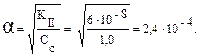 Равновесная концентрация [H+] = 𝑎· См при С = 1 моль/л. [H+] = 2,4 · 10–4 моль/л,
Равновесная концентрация [H+] = 𝑎· См при С = 1 моль/л. [H+] = 2,4 · 10–4 моль/л,
рН = –lg[H+] = –lg (2,40 · 10–4) = 3,60.
Контрольные вопросы
1. В чем состоит различие между гидратацией иона и гидролизом иона?
2. Как влияет на глубину протекания гидролиза соли заряд катиона и его радиус?
3. Какие факторы влияют на степень гидролиза соли?
4. Расположите перечисленные катионы в ряд по возрастанию способности к гидролизу: Al3+, Cr3+, Fe3+.
5. В какой цвет окрасится каждый из растворов К2СО3 и NH4Cl при добавлении следующих индикаторов:
а) метилового оранжевого;
б) фенолфталеина?
Напишите реакции гидролиза этих солей.
6. Напишите уравнения реакций гидролиза следующих солей: сульфат меди (II), карбонат аммония, фосфат натрия, хлорид железа (III).
7. Укажите реакцию среды водных растворов следующих солей:
а) иодид калия, бромид аммония, сульфид натрия;
б) дигидрофосфат калия, нитрат калия, цинкат натрия;
в) хлорид хрома (III), хлорид бария, сульфат калия.
8. Какие условия необходимо создать, чтобы подавить гидролиз сульфата железа (II)?
9. Как изменится степень гидролиза цианида натрия при добавлении к раствору:
а) гидроксида натрия;
б) хлороводородной кислоты?
10. Почему гидролиз сульфида хрома (III) идет необратимо? Ответ подтвердите уравнением реакции.
11. При взаимодействии растворов Fe2(SO4)3 и K2CO3 выпадает осадок гидроксида железа (III)? Дайте пояснения, напишите реакции.
12. При равных концентрациях солей степень гидролиза какой соли больше: NH4NO2 или NH4СN? Ответ подтвердите расчетами.
13. В какой последовательности уменьшаются значения рН водных растворов приведенных ниже солей с одинаковой молярной концентрацией:
а) нитрит калия;
б) нитрат калия.
в) сульфат меди (II)
14. Какую реакцию среды (кислую, нейтральную, щелочную) имеют водные растворы следующих солей:
а) цианид аммония;
б) ацетат аммония;
в) фторид аммония.
 2020-06-08
2020-06-08 818
818








