Тема: Окислительно-восстановительные реакции
Задачи:
- закрепить понятие «степень окисления»;
- осуществить контроль сформировнности умения определять степени окисления элементов в бинарных соединениях, в соединениях, состоящих из трех элементов;
- сформировать представление об окислителе и восстановителе, про окислительно-восстановительные процессы с точки зрения перехода электронов;
- продолжить развитие и совершенствование основных мыслительных операций (анализ, синтез, сравнение, обобщение);
- воспитывать культуру общения.
Мотивация и целеполагание:
Вы уже знакомы с различными типами химических реакций: соединения, разложения, замещения, обмена; химическими свойствами веществ различных классов.
Ребята, мы с вами классифицировали реакции по различным признакам. Но сейчас мы познакомимся с реакциями, в результате которых атомы химических элементов изменяют свою степень окисления.
Изучение нового материала:
Сравним две реакции: первая реакция – взаимодействие гидроксида натрия с соляной кислотой.
NaOH + HCl = NaCl + H2O.
Расставим степени окисления у всех атомов. У натрия степень окисления +1, у кислорода -2, у водорода +1, в соляной кислоте у водорода степень окисления +1, а у хлора -1. В хлориде натрия у натрия степень окисления +1, у хлора -1, в воде у водорода степень окисления +1, у кислорода -2. Как видно, атомы химических элементов не изменили свои степени окисления.
Сравним вторую реакцию – взаимодействие магния с соляной кислотой.
Mg + 2HCl = MgCl2 + H2↑.
У магния степень окисления нуль, т.к. это простое вещество, у водорода в соляной кислоте +1, у хлора -1, в хлориде магния у магния степень окисления +2, у хлора -1, у водорода, как простого вещества степень окисления равна нулю. Следовательно, в данной реакции магний и водород изменили свои степени окисления: магний с нуля до +2, а водород с +1 до нуля. Т.е. каждый атом магния отдал два электрона, а каждый атом водорода принял по одному электрону.
0 +2
Mg - 2ē → Mg
+1 0
2H + 2ē → H2
Эти химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, называют окислительно-восстановительными реакциями.
Процесс присоединения электронов атомами, ионами или молекулами называется восстановлением. Степень окисления при этом понижается. В нашем случае атомы водорода присоединяют электроны и понижают свою степень окисления, т.е. этот процесс является восстановлением. Например, атомы неметаллов могут присоединять электроны и превращаться при этом в отрицательные ионы, т.е. они восстанавливаются. Так атом серы может присоединить два электрона и превратиться в сульфид-ион, где степень окисления серы -2.
0 -2
S + 2ē → S
Электроны могут присоединяться и к положительным ионам, которые при этом превращаются в нейтральные атомы или положительные ионы, у которых степень окисления понижается.
+3 0
Fe + 3ē → Fe
+3 +2
Fe + 1ē → Fe
Т.е. ион железа (III) и атом серы являются окислителями. Т.о., атомы, ионы или молекулы, принимающие электроны, называют окислителями.
Процесс отдачи электронов атомами, ионами или молекулами называется окислением. При этом степень окисления повышается. Атомы металлов отдают электроны, превращаются при этом в положительные ионы, т.е. они окисляются. Например, атом кальция отдает два электрона и превращается в ион кальция, со степенью окисления +2.
0 +2
Са - 2ē → Са
Отдавать электроны могут также и отрицательные, и положительные ионы. Например, сульфид ион отдает два электрона и превращается в атом серы, или ион железа (II) отдает один электрон и превращается в ион железа (III).
-2 0
S - 2ē → S
+2 +3
Fe - 1ē → Fe
Атомы, ионы или молекулы, которые отдают электроны, называют восстановителями. В нашем случае, это сульфид-ион и ион железа (II).
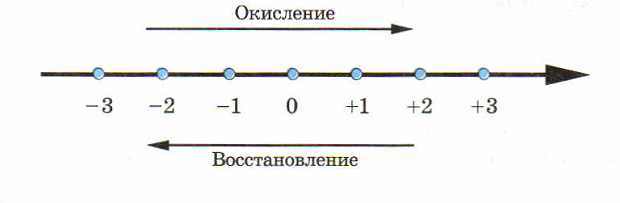 Все окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления.
Все окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления.
Рассмотрим реакцию взаимодействия алюминия с серой. В нашем случае атом алюминий отдает три электрона и становится ионом алюминия со степенью окисления +3. Т.е. он является восстановителем, при этом он повышает свою степень окисления, а сам он окисляется. Атом серы, напротив, принимает два электрона, понижает свою степень окисления и превращается в сульфид-ион, где степень окисления серы -2. Атом серы является окислителем, т.е. он восстанавливается.

В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т.е. соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления. Например, при записи уравнения реакции алюминия и серы над каждым атомом и ионом ставят степени окисления.
0 0 +3 -2
Al + S = Al2S3
А в электронных уравнениях указывают число отдаваемых и принимаемых электронов, указывают восстановитель и окислитель, процессы окисления и восстановления.
Al - 3ē → Al 2 восстановитель; окисление
S + 2ē → S 3 окислитель; восстановление
Молекулярное уравнение этой реакции записать несложно, т.к. коэффициенты для него будут взяты из электронных уравнений.
2Al + 3S = Al2S3
Так, перед алюминием будет стоять коэффициент 2, а перед серой – 3.
Попробуем расставить коэффициенты методом электронного баланса в более сложной реакции. Как вы помните, азотная кислота любой концентрации и концентрированная серная кислота реагирует с металлами иначе, чем другие кислоты. Запишем реакцию взаимодействия серебра с разбавленной азотной кислотой. В результате реакции образуется соль – нитрат серебра (I), оксид азота (II) и вода. Укажем степени окисления у атомов и ионов.
Ag + H N O3 → Ag NO3 + N O↑ + H2O
Подчеркнем знаки химических элементов, изменивших свои степени окисления. В нашем случае – это серебро и азот. Составим электронные уравнения, отразив процессы восстановления и окисления.
Ag - 1ē → Ag 3 восстановитель; окисление
N + 3 ē → N 1 окислитель; восстановление
В реакциях между металлом и кислотой, коэффициенты ставят, как правило, сначала перед продуктами реакции, а затем перед исходными веществами. Значит, перед формулой нитрата серебра (I) ставим коэффициент 3, а перед оксидом азота (II) коэффициент 1.
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Следовательно, и перед формулой серебра в левой части уравнения нужно поставить коэффициент 3. Считаем число атомов азота после реакции, 4 атома, до реакции один атом, значит, перед формулой азотной кислоты нужно поставить коэффициент 4. Считаем число атомов водорода в левой части уравнения, их – 4, в правой – 2, значит, перед формулой воды нужно поставить коэффициент 2. Считаем число атомов кислорода: в левой части 12, в правой тоже, теперь мы можем поставить знак равенства вместо стрелки.
Зная степень окисления атомов химических элементов нетрудно предсказать окислителем или восстановителем будет элемент или вещество. Например, в азотной кислоте (HNO3) степень окисления азота максимальная +5, следовательно, он «потерял» все электроны, поэтому азотная кислота будет проявлять только окислительные свойства. В аммиаке (NH3) степень окисления азота минимальная -3, т.е. он не может больше принимать электроны и может быть только восстановителем. В оксиде азота (II) степень окисления азота +2, т.е. является промежуточной, поэтому он может проявлять и восстановительные, и окислительные свойства.
Наиболее важными восстановителями являются активные металлы, водород (H2), уголь, оксид углерода (II) – CO, сероводород – H2S, аммиак (NH3) и др. Наиболее важными окислителями являются: кислород (O2), галогены, азотная кислота (HNO3), серная кислота (H2SO4), перманганат калия (KMnO4) и др.
Закрепление и контроль знаний:
1. Укажите процессы окисления и восстановления:
а) Mg0 - 2ē → Mg+2;
б) S0 - 4ē → S+4;
в) S0 + 2ē → S-2;
2. В приведенных уравнениях химических реакций укажите окислитель и восстановитель, а также число и направление перемещения электронов:
а) Zn + 2HCl = ZnCl2 + H2↑;
б) 2Al + 3Br2 = 2AlBr3;
3. Расставьте коэффициенты в уравнениях химических реакций методом электронного баланса, укажите восстановитель и окислитель, процессы окисления и восстановления:
а) Ca + HCl = CaCl2 + H2↑;
б) K + S = K2S;
в) KNO3 = KNO2 + O2↑;
Рефлексия и подведение итогов:
Задание. Оцените свои знания о каждом конкретном понятии по десятибалльной системе. Если ваш график неуклонно идёт вниз – материал вами не усвоен. Если выстроенный вами график представляет линию, лежащую выше отметки «6», то ваши знания достаточны.
балл
элементы знаний
Баллы: 2, 4, 6, 8, 10; элементы знаний: с.о., ок-ль, вост-ль, восст-ие, ок-ие, ОВР.
 2020-06-08
2020-06-08 50
50






