Качественные реакции на жиры
Акролеиновая проба. Данная проба проводится для обнаружения в липидах глицерола. При нагревании глицерола в присутствии водоотнимающих средств (гидросульфата калия, борной кислоты либо сульфата магния) происходит образование непредельного акрилового альдегида – акролеина:
СН2ОН–СНОН–СН2ОН ® СН2=СН–СНО + 2Н2О.
Акролеин имеет специфический раздражающий запах. Обнаружить присутствие в выделяемых парах можно также по реакции с аммиачным раствором оксида серебра. Имеющий альдегидную группу акролеин способен восстанавливать Ag2O до металлического серебра, вызывая почернение участка фильтровальной бумаги, смоченной в аммиачном растворе оксида серебра. Механизм данной реакции аналогичен механизму реакции «серебряного зеркала», характерной для восстанавливающих моносахаридов. Точно так же качественной реакцией на альдегидную группу акролеина может служить реакция с фуксинсернистой кислотой. В этом случае фильтровальная бумага, смоченная в растворе фуксинсернистой кислоты и выдержаная в парах акролеина, приобретает ярко-розовую окраску.
Липиды, не содержащие глицерола (воска, стероиды и др.), акролеиновой пробы не дают. В частности, при проведении этой реакции с воском образование акролеина не происходит.
Пробы с осмиевой кислотой и c суданом III. Осмиевая кислота и судан III являются специфическими красителями на жиры и часто используются для окрашивания образцов в микроскопии. В случае осмиевой кислоты жир приобретает черную окраску, а краситель судан III окрашивает его в различные оттенки красного цвета.
Количественное определение жирных кислот c диэтилдитиокарбаматом
При взаимодействии жирных кислот с медь-триэтаноламиновым реактивом (уксусная кислота: нитрат меди: триэтаноламин в соотношении 1:10:9) образуются медные соли жирных кислот. В свою очередь диэтилдитиокарбамат (ДЭДТК) [(C2H5)2NCSSNa], специфически взаимодействуя с медью в составе полученных медных солей жирных кислот, обеспечивает количественно пропорциональное окрашивание раствора.
Качественные реакции на холестерол
Рассматриваемые в данной работе качественные реакции на холестерол (реакции Шиффа, Сальковского и Либермана-Бурхарда) сходны друг с другом по природе химических превращений. Под действием серной кислоты происходят дегидратация и окисление холестерола. В результате этого две молекулы холестерола, потерявшие по одной молекуле воды, соединяются между собой по третьему атому углерода, образуя вещества, соответствующие суммарным формулам С54Н86 и С54Н88 (в зависимости от положения двойных связей). Эти непредельные углеводороды с сопряженными двойными связями дают различные производные с серной кислотой и уксусным ангидридом. Указанные реакции характерны не только для холестерола, но и для других стеролов, а также для холевой кислоты.
Реакция Шиффа. При наслаивании концентрированной серной кислоты на раствор холестерола на границе раздела двух жидкостей появляется оранжевое кольцо, которое при стоянии переходит в красное.
Реакция Сальковского. При легком встряхивании полученной в предыдущем опыте смеси после отслаивания верхний слой жидкости окрашивается в красный цвет, нижний имеет желто-оранжевую окраску с зеленой флуоресценцией (жидкость в проходящем свете прозрачная желто-красная, в отраженном свете кажется мутной с зеленым оттенком).
Реакция Либермана-Бурхарда. При добавлении к раствору холестерола реактива Либермана-Бурхарда (смесь серной и уксусной кислот, а также уксусного ангидрида) вначале появляется красное окрашивание, которое затем переходит в фиолетовое, синее и зеленое. При незначительном содержании холестерола в растворе сразу появляется зеленое окрашивание.
Количественное определение общего холестерола
Метод Илька. Принцип метода основан на реакции Либермана-Бурхарда: холестерол в присутствии уксусного ангидрида и смеси уксусной и серной кислот дает зеленое окрашивание с интенсивностью, пропорциональной концентрации холестерола.
Методы определения желчных кислот
Желчные кислоты имеют полностью насыщенный стерановый скелет и боковую цепь, состоящую из 5 атомов углерода. Известны 4 желчные кислоты, из них две первичные и две вторичные. Первичные желчные кислоты синтезируются в печени из продуктов распада холестерина и поступают в двенадцатиперстную кишку. К первичным желчным кислотам относятся: холевая кислота, содержащая гидроксильные группы в 3-м, 7-м и 12-м положениях, и хенодезоксихолевая кислота, содержащая только две гидроксильные группы в 3-м и 7‑м положениях.
Вторичные желчные кислоты синтезируются в кишечнике из первичных желчных кислот под действием ферментов микрофлоры. К ним относятся: дезоксихолевая кислота, имеющая гидроксильные группы в 3-м и 12-м положениях, и литохолевая, содержащая гидроксильную группу только в 3-м положении.
В желчи содержатся, главным образом, конъюгаты желчных кислот с глицином и таурином в виде, например, гликохолевой и таурохолевой кислот.
Амфифильная природа желчных кислот и их солей обусловливает их поверхностно-активные свойства и участие в переваривании жиров.
Качественные реакции на желчные кислоты
Проба Гея –основана на том, что желчные кислоты являются поверхностно-активными веществами, снижающими поверхностное натяжение раствора. В связи с этим порошок серы, помещенный на поверхность раствора желчных кислот, тонет, в то время как в воде порошок серы не тонет.
Проба Петенкоффера – основана на образовании окрашенного продукта при взаимодействии желчных кислот и оксиметилфурфурола. Последний образуется из сахарозы при действии концентрированной серной кислоты. При наличии в растворе желчных кислот он приобретает красно-фиолетовую окраску.
Контрольные вопросы
1. Биологические функции липидов.
2. Общие свойства, классификация и номенклатура липидов.
3. Жирные кислоты. Насыщенные и ненасыщенные жирные кислоты.
4. Строение и свойства нейтральных жиров. Воска.
5. Методы оценки физико-химических свойств жиров.
6. Качественные реакции на жиры.
7. Количественное определение жиров.
8. Строение и свойства стероидов. Холестерол и его эфиры.
9. Желчные кислоты. Их биологическая роль.
10. Качественные реакции на холестерол, желчные кислоты.
11. Количественное определение холестерола.
Ход работы.
При помощи этих ссылок вы можете посмотреть видео опыты.
https://www.youtube.com/, https://yandex.ru/video
1. Определение непредельности высших жирных кислот
2. Растворение жиров
4. Омыление (щелочной гидролиз) жиров
5. Получение свободных жирных кислот
6. Качественные реакции на жиры
7. Качественные реакции на холестерол
8. Качественные реакции на желчные кислоты
9. Количественное определение жирных кислот
СВОЙСТВА ЖИРОВ
w Определение непредельности высших жирных кислот
1. В пробирку помещают 10 капель бромной воды.
2. Затем добавляют 3 капли масла и смесь встряхивают.
3. Отмечают изменение окраски бромной воды. Объясняют наблюдаемое явление и делают выводы о присутствии непредельных жирных кислот в составе данного масла.
w Растворение жиров
1. В 4 пробирки помещают по 3 капли масла (жира).
2. Затем в первую пробирку добавляют 2 мл керосина (бензина), во вторую – 2 мл хлороформа, в третью – 2 мл эфира, в четвертую – 2 мл спирта.
3. Отмечают различия в растворимости данного масла (жира) в приведенных растворителях. Объясняют получаемые результаты и делают выводы.
1. В 6 пробирок помещают по 3 капли масла (жира) и 2 мл воды.
2. Затем в первую пробирку добавляют 5 капель раствора белка, во вторую – 5 капель NaOH, в третью – 5 капель раствора NaHCO3 (сода), в четвертую – 5 капель раствора мыла, в пятую – 5 капель раствора желчи, а шестую пробирку оставляют в качестве контроля.
3. Содержимое пробирок перемешивают. (Если в эксперименте используется твердый жир, пробирки предварительно инкубируют в горячей водяной бане для его плавления.)
4. Отмечают поведение данного масла (жира) в каждой из пробирок. Объясняют полученные результаты и делают выводы.
w Омыление (щелочной гидролиз) жиров
1. Взвешивают 2 г жира (или масла), вносят в пробирку и добавляют к нему 6 мл 15%-ного спиртового раствора NaOH.
2. Омыление проводят при температуре около 30 °С в течение 10‑12 минут.
3. Для определения окончания реакции омыления несколько капель гидролизата вливают в небольшое количество горячей дистиллированной воды. при закончившемся омылении гидролизат полностью растворяется в воде.
4. По окончании омыления смесь выливают в фарфоровую чашку, добавляют 20–30 мл воды.
5. Затем путем нагревания содержимого чашки на водяной бане удаляют спирт, при этом объем раствора уменьшается приблизительно наполовину.
6. После упаривания раствор доводят до объема 20 мл дистиллированной водой. Результирующий раствор используется для получения свободных жирных кислот.
w Получение свободных жирных кислот
1. К 3 мл раствора, полученного в предыдущем опыте, добавляют 10%-ную HCl до кислой реакции.
2. Наблюдают образование белой мути, постепенно всплывающей в виде жировых капель на поверхности водного слоя (свободные жирные кислоты).
3. Добавляют 5 мл эфира, отверстие пробирки закрывают пробкой и встряхивают. Жировые капли растворяются, водный слой становится прозрачным.
4. осторожно отсасывают эфирный слой пипеткой и переносят несколько капель на предметное стекло. После испарения эфира на стекле остается налет.
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ЖИРЫ
w Акролеиновая проба на жиры
1. В пробирку вносят 3 капли масла (жира) и добавляют пятикратное количество безводного гидросульфата калия (либо безводного сульфата магния, либо борной кислоты).
2. Пробирку осторожно нагревают до появления белых густых паров.
3. Отмечают (осторожно!) резкий раздражающий запах акролеина.
4. В пары вносят кусочек фильтровальной бумаги, смоченный аммиачным раствором оксида серебра.
5. Отмечают изменение окраски фильтровальной бумаги. Объясняют полученный результат.
6. Затем в пары вносят кусочек фильтровальной бумаги, смоченный фуксинсернистой кислотой.
7. Отмечают изменение окраски фильтровальной бумаги. Объясняют полученный результат.
8. Такой же эксперимент (пункты 1–7) проводят с кусочком воска.
9. Делают выводы о строении используемого в данном опыте жира и воска.
w Проба с осмиевой кислотой
1. На предметное стекло наносят 1 каплю масла.
2. В нее добавляют 1 каплю 1%-ного раствора осмиевой кислоты.
3. Отмечают изменение окраски. Объясняют полученный результат и делают выводы.
w Проба с суданом III
1. На предметное стекло наносят 1 каплю масла.
2. В нее добавляют 1 каплю раствора судана III.
3. Отмечают изменение окраски. Объясняют полученный результат и делают выводы.
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ХОЛЕСТЕРОЛ
w Реакция Шиффа
1. В пробирку наливают 10 капель 1%-ного хлороформного раствора холестерола.
2. Далее добавляют равный объем концентрированной серной кислоты (осторожно, по стенке пробирки).
3. Отмечают появление окрашенного кольца на границе слоев, а также изменение окраски со временем. Объясняют наблюдаемое явление и делают выводы.
w Реакция Сальковского
1. После проведения пробы Шиффа жидкость осторожно встряхивают, перемешивая содержимое пробирки.
2. Отмечают окрашивание различных частей раствора (после отстаивания), а также изменение окраски со временем. Объясняют полученный результат и делают выводы.
w Реакция Либермана-Бурхарда
1. В пробирку наливают 10 капель 1%-ного раствора холестерола в хлороформе.
2. Затем добавляют 5 капель реактива Либермана-Бурхарда.
3. Содержимое пробирки осторожно встряхивают и помещают в баню при температуре 40 °С на 2 мин. или оставляют при комнатной температуре на 10 мин.
4. Отмечают изменение окраски. Объясняют полученный результат и делают выводы.
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ЖЕЛЧНЫЕ КИСЛОТЫ
w Проба Гея
1. В пробирку вносят 3 мл раствора желчных кислот, во вторую – 3 мл воды.
2. Затем добавляют по 1 шпателю порошка серы.
3. Отмечают различное поведение серы в присутствии и в отсутствие желчных кислот.
w Проба Петенкоффера
1. В пробирку наливают 2 мл раствора желчных кислот.
2. Затем добавляют 0,5 мл 5%-ного раствора сахарозы.
3. Осторожно, по стенке пробирки, добавляют 1 мл концентрированной серной кислоты.
4. Оставляют на 15 мин. пробирку в штативе.
5. Отмечают появление окраски. Объясняют полученный результат и делают выводы.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ЖИРНЫХ КИСЛОТ
w Количественное определение жирных кислот с диэтилдитиокарбаматом
1. В одну пробирку помещают 0,5 мл образца, а в другую 0,5 мл стандартного раствора пальмитиновой (стеариновой) кислоты.
2. В обе пробирки добавляют по 5 мл хлороформа и по 2,5 мл медного
реактива.
3. Пробирки закрывают полиэтиленовыми пробками и встряхивают 3 мин.
4. Далее, не открывая пробирки, пробы центрифугируют 15 мин при 3000 об/мин. В результате жидкость разделяется на 3 фазы: медный раствор, водная фаза (верхняя); белковая фаза (средняя); органическая фаза (нижняя).
Примечание: Если полученная нижняя органическая фаза не прозрачна (т.е. в ней присутствует белок), тонкой стеклянной палочкой обводят по стенкам пробирки так, чтобы белок прилип к ней.
5. Затем 3 мл нижнего слоя отбирают в отдельную пробирку с помощью шприца с длинной иглой.
6. К 3 мл отобранной фракции добавляют 0,5 мл 0,1%-ного раствора ДЭДТК в н-бутаноле. Окраска развивается немедленно.
7. Оптическую плотность раствора измеряют при 445 нм (синий светофильтр) против холостой пробы, содержащей воду.
8. Концентрацию жирных кислот в образце определяют по формуле
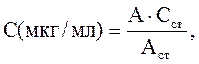
где С – концентрация жирных кислот в исследуемом образце,
А – оптическая плотность, Сст – концентрация пальмитиновой (стеариновой) кислоты в стандартном растворе (50мкг/мл), Аст – оптическая плотность стандартного раствора
Примечание: При определении количества жирных кислот в тканях животных для каждой ткани подбирают соответствующее разведение.
 2020-06-08
2020-06-08 2767
2767