Электролиз расплавов и растворов (солей, щелочей, кислот)
Электролиз – окислительно-восстановительные процессы, протекающие при пропускании постоянного тока через раствор или расплав электролита.
И в растворе, и в расплаве электролит (соль, кислота, основание) распадается на ионы, и раствор и расплав электролита проводит электрический ток. Но в растворе присутствуют молекулы воды, которые могут участвовать в окислительно-восстановительных процессах вместо ионов электролита. Электролиз расплава – более простой процесс, окисляются и восстанавливаются только ионы вещества.
Электролиз расплавов
Рассмотрим электролиз расплава хлорида натрия. В расплаве NaCl распадается на те же ионы, что и в растворе:
NaCl (расплав) = Na+ + Cl–
Для проведения электролиза в расплав погружают два токоподвода – электрода (рисунок 2).
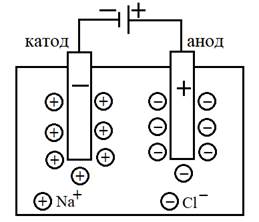
Рисунок 2 – Схема электролиза расплава NaCl
При пропускании постоянного тока на одном из электродов – катоде – создается избыток электронов, он заряжается отрицательно; на другом электроде – аноде – недостаток электронов, он заряжается положительно. Ионы расплава при пропускании тока устремляются к противоположно заряженному электроду и на нем разряжаются:
на отрицательном электроде – катоде – идет процесс восстановления:
Na+ + ē = Na0
на положительном электроде – аноде – идет процесс окисления:
2Cl– – 2ē = Cl02
Таким образом, на катоде образуется простое вещество натрий, на аноде – простое вещество хлор. Уравнение реакции электролиза:
2 NaCl (расплав)  2Na + Cl2
2Na + Cl2
катод анод
В ЕГЭ немного заданий на электролиз расплавов, намного больше – на электролиз растворов. Тем не менее, электролиз расплавов – способ получения активных металлов – щелочных, щелочноземельных, алюминия. Только электролизом расплава можно получить простое вещество фтор.
Промышленное значение имеет электролиз галогенидов и гидроксидов. Рассмотрим электролиз расплава гидроксида калия:
В расплаве гидроксид калия диссоциирует:
KOH (расплав) = K+ + OH–
На катоде (–):
восстанавливаются ионы калия:
K+ + ē = K0
На аноде (+):
окисляется кислород из гидроксид-иона:
4ОН– – 4 ē = О2 + 2Н2О
Суммарно процесс электролиза расплава гидроксида калия выражается уравнением:
4KOH (расплав)  4K + О2 + 2H2O
4K + О2 + 2H2O
катод анод
Таким образом, у катода образуется металл калий, у анода – газ кислород и вода.
Электролиз растворов
В растворе процессы электролиза существенно усложняются, так как кроме ионов вещества присутствуют молекулы воды.
На катоде может идти восстановление Н+ из молекулы воды:
2Н2О + 2 ē = H2 + 2OH–
На аноде может окисляться анион О2–:
2Н2О – 4 ē = О2 + 4H+
Что восстанавливается на катоде (катион вещества или вода) и что окисляется на аноде (анион вещества или вода), определяется природой электролита, а точнее – значением электродного потенциала. На катоде в первую очередь идут процессы, характеризующиеся более положительным потенциалом, т.е. восстанавливаются более сильные окислители. На аноде в первую очередь окисляются более сильные восстановители, т.е. идут процессы, характеризующиеся более отрицательным потенциалом. В школьную программу электродные потенциалы не входят, поэтому для решения задач нужно запомнить некоторые общие правила, рассмотрим их ниже.
Кроме того, имеет значение материал, из которого изготовлены электроды. Обычно используют электроды из инертного материала, не реагирующего с раствором и трудно окисляемого: например, графит или платина. Можно также использовать электроды из металла средней активности: часто используют никель, медь, олово. Тогда металлический анод будет окисляться, ионы металла будут переходить в раствор, в этом случае говорят об электролизе с растворимым анодом. Материал катода не имеет существенного значения – даже металлический катод защищен от окисления в растворе внешними электронами.
Возможные процессы на катоде при электролизе растворов
При пропускании постоянного тока к катоду подходят катионы: в растворах солей и оснований это ионы металлов разной активности (электролиз растворов солей аммония осложняется побочными процессами и в школьную программу не входит), в растворах кислот – ионы водорода. Катодный процесс зависит от активности данного металла.
В растворе присутствуют катионы активного металла, в ряду активности – от лития до алюминия включительно.
Эти металлы – очень сильные восстановители, они легко окисляются. При электролизе растворов катионы этих металлов не будут восстанавливаться, будет идти восстановление Н+ из молекулы воды:
2Н2О + 2 ē = H2 + 2OH–
Таким образом, активные металлы (в том числе алюминий), можно получить только электролизом расплава, а при электролизе раствора в прикатодном пространстве можно получить гидроксиды металлов.
В растворе присутствуют катионы металлов средней активности, расположенные в ряду активности от марганца до водорода.
Эти металлы можно получить на катоде, пропуская ток через раствор, но параллельно будет происходить и восстановление Н+:
Me+ n + n ē = Me0
2Н2О + 2 ē = H2 + 2OH–
Выделение газа водорода считается побочным процессом, во многих задачах им пренебрегают.
В растворе присутствуют катионы металлов, стоящих в ряду активности после водорода.
Эти металлы легко восстанавливаются на катоде:
Me+ n + n ē = Me0
В растворе в качестве катионов присутствуют только Н+ (растворы кислот), на катоде идет процесс их восстановления:
2Н+ +2 ē = H2
 2020-06-08
2020-06-08 280
280







