Химические свойства
Смотреть по ссылке (продолжение): https://www.youtube.com/watch?v=PdmRp01Wa0M
I. Реакции с разрывом связи О-Н (кислотные свойства, обусловленные подвижностью атома “Н” карбоксильной группы).Предельные одноосновные карбоновые кислоты обладают всеми свойствами обычных кислот.
1) Диссоциация
О О
R – C ↔ R – C + Н+
ОН О –
2. Образование солей:
а) взаимодействие с активными металлами:
2НСООН + Мg → (НСОО)2 Мg + Н2
формиат магния
б) взаимодействие с основными оксидами:
2СН3СООН + СаО → (СН3СОО)2Са + Н2О
ацетат кальция
в) взаимодействие со щелочами (реакции нейтрализации):
СН3СООН + NaOH → СН3СООNa + Н2О
ацетат натрия
г) взаимодействие с аммиаком или гидроксидом аммония:
СН3СООН + NН3 → СН3СООNН4
ацетат аммония
д) взаимодействие с солями более слабых кислот (карбонатами и гидрокарбонатами):
2СН3СООН + Na2CO3 → 2СН3СООNa + CO2↑+ Н2О
ацетат натрия
II. Реакции с разрывом связи С-О (замещение группы ОН) О
Взаимодействие со спиртами с образованием сложных эфиров R – C (реакция этерификации)
ОR
О Н2SO4 конц. О
СН3 – С – ОН + С2Н5ОН ↔ СН3 – С – ОС2Н5 + Н2О
уксусная кислота этилацетат
III. Реакции с разрывом связей С-Н (реакции с участием радикала), в присутствии Ркрасный
1) СН3 – СООН + Сl2 → СН2Сl – СООН + НСl
хлоруксусная кислота
2) СН3 – СООН + Сl2 → СНСl2 – СООН + НСl
дихлоруксусная кислота
3) СН3 – СООН + Сl2 → ССl3 – СООН + НСl
трихлоруксусная кислота
Лабораторная работа № 12
«Свойства уксусной кислоты, общие со свойствами минеральных кислот»
Цель работы: изучить свойства карбоновых кислот.
Оборудование и реактивы: штатив с пробирками (3 шт.), пробка с длинной стеклянной трубкой-холодильником, химический стакан, уксусная кислота (70%), магний, цинк, фенолфталеин, гидроксид натрия, этанол, серная кислота (конц.), вода, хлорид натрия.
Ход работы:
Смотреть по ссылке: https://www.youtube.com/watch?v=fU0Pg8tIEqg
Опыт № 1. Взаимодействие уксусной кислоты с некоторыми металлами.
В две пробирки влейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, а во вторую – несколько гранул цинка. В первой пробирке происходит бурная реакция, а во второй – реакция протекает спокойно (иногда она начинается только при нагревании).
Задания для самостоятельного вывода:
1. Как уксусная кислота реагирует с магнием и цинком?
2. Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
Опыт № 2. Взаимодействие уксусной кислоты с основаниями.
Влейте в пробирку 1-1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавление уксусной кислоты происходит обесцвечивание.
Опыт № 3. Взаимодействие уксусной кислоты со спиртами. https://www.youtube.com/watch?v=C0JOH3v-2Rk
В пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл этанола. Затем в пробирку осторожно добавьте 1 мл концентрированной серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте. Жидкость налейте в сосуд с насыщенным раствором хлорида натрия.
Задания для самостоятельного вывода:
1. Какие свойства уксусной кислоты сходны со свойствами минеральных кислот?
2. Какие вещества образуются при взаимодействии уксусной кислоты с основаниями?
3. Какие вещества образуются при взаимодействии уксусной кислоты со спиртами?
4. Напишите уравнения всех этих трѐх опытов.
5. Составьте уравнения реакций муравьиной кислоты: а) с цинком; б) с гидроксидом калия; в) с содой.
Получение предельных монокарбоновых кислот
I. Общие способы получения.
1. Окисление первичных спиртов и альдегидов под действием различных окислителей:
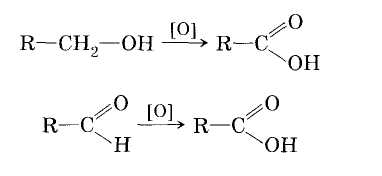
2. Окисление алканов кислородом воздуха (в присутствии катализаторов)
2СН3 – СН2 – СН2 – СН3 + 5О2 → 4СН3 – СООН + 2Н2О
бутан уксусная кислота
В лаборатории карбоновые кислоты получают из их солей, действуя на них серной кислотой при нагревании:
t
СН3СООNa + Н2SО4 → Na2SО4 + СН3СООH
ацетат натрия уксусная кислота
 2020-06-08
2020-06-08 175
175







