Химические реакции, в которых исходные вещества расходуются полностью, называются необратимыми. Такие реакции протекают только в одном направлении, например: 2KClO3®2KCl+3O2
Известны также обратимые реакции, которые не идут до конца, и могут протекать одновременно как в прямом, так и в обратном направлениях. В уравнениях обратимых реакций знак равенства заменяют знаком ⇄, т. е. стрелками в направлении прямой и обратной реакций: CO2+H2O⇄H2CO3
По мере протекания реакции, т. е. с убыванием концентраций исходных веществ, скорость прямой реакции уменьшается. Одновременно происходит накопление продуктов реакции, вследствие чего увеличивается скорость обратной реакции. В некоторый момент времени скорости прямой и обратной реакций становятся одинаковыми и в системе устанавливается состояние химического равновесия, при котором уже не происходит изменение концентраций исходных и конечных веществ при неизменных внешних условиях. Концентрации всех участвующих в реакции веществ, которые устанавливаются при химическом равновесии, называются равновесными, и обозначаются с помощью квадратных скобок, например: [СО2], [Н2СО3] и т. п. Следует отметить, что химическое равновесие обусловлено не прекращением реакции, а равенством скоростей непрерывно протекающих прямой и обратной реакций, т. е. химическое равновесие является динамическим (подвижным).
Для обратимой реакции в общем виде aA+bB⇄cC+dD на основании закона действия масс скорости прямой и обратной реакций выразятся уравнениями:
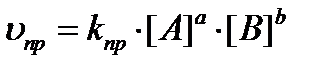
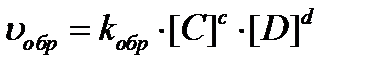
В состоянии химического равновесия υпр = υобр, следовательно:
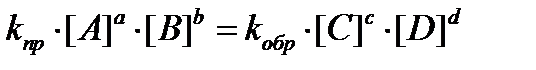
или константа химического равновесия:
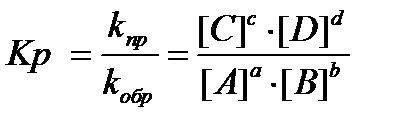
Kр - характерная для каждой реакции величина, не зависящая от концентраций, но зависящая от природы участвующих в реакции веществ и температуры. Константа равновесия показывает, во сколько раз прямая реакция протекает быстрее (или медленнее) обратной реакции при данной температуре и равновесных концентрациях реагентов, равных 1 моль/л.
Система, находящаяся в состоянии химического равновесия, может сохранять его длительное время при неизменных внешних условиях. При изменении хотя бы одного из условий его существования прежнее равновесие нарушается, так как при этом скорости прямой и обратной реакций изменяются неодинаково. Происходящие при этом в системе изменения протекают до тех пор, пока при новых условиях не установится равенство скоростей прямой и обратной реакций, т.е. новое состояние равновесия, характеризующееся новыми значениями равновесных концентраций всех растворов и, следовательно, новыми значениями скоростей.
Переход системы из одного равновесного состояния в другое называется смещением химического равновесия. Если при изменении внешних условий скорость прямой реакции возрастает больше, чем скорость обратной реакции, то равновесие смещается вправо. Если при нарушении равновесия скорость обратной реакции становится больше скорости прямой реакции, то равновесие смещается влево. Направление смещения равновесия при изменении условий его существования определяет принцип Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект воздействия.
Смещение равновесия может быть вызвано изменением концентраций реагирующих веществ, давления и температуры.
При изменении концентрации одного из реагентов (добавлении вещества в равновесную систему или выводе его из системы) равновесие смещается в сторону, компенсирующую изменение концентрации: при увеличении концентрации вещества равновесие смещается в том направлении, при котором концентрация этого вещества уменьшается, и, наоборот, при уменьшении концентрации вещества - в направлении образования этого вещества. Очевидно, что при увеличении концентрации исходного вещества смещение равновесия происходит вправо (в сторону прямой реакции), при увеличении концентрации конечного - влево (в сторону обратной реакции). При уменьшении концентрации исходного вещества равновесие смещается влево, а при уменьшении концентрации конечного - вправо.
Повышение температуры смещает равновесие в сторону реакции, которая сопровождается поглощением тепла, т. е. в сторону эндотермической реакции (DH>0). Понижение температуры, наоборот, приводит к смещению равновесия в сторону экзотермической реакции (DH<0), т. е. реакции, протекающей с выделением тепла.
Давление оказывает влияние на смещение равновесия, если в реакции участвует, хотя бы одно газообразное вещество. При повышении давления имеет место увеличение концентрации газообразного реагента, поэтому равновесие обратимого процесса смещается в направлении расхода газообразного компонента, т. е. в направлении понижения давления. При понижении давления вследствие уменьшения концентрации газа равновесие смещается в направлении возрастания концентрации газообразного вещества, т. е. в направлении повышения давления. Если в реакции участвуют несколько газообразных веществ, то повышение давления в системе приводит к смещению равновесия в направлении реакции, сопровождающейся уменьшением числа молей газообразных веществ, что вызывает понижение давления. И, наоборот, при понижении давления равновесие смещается в направлении образования большего числа молей газа, что вызывает повышение давления в системе, противодействуя внешнему воздействию.
Если обратимая реакция протекает без изменения числа молей газообразных веществ, то давление не смещает равновесие реакции, например: N2 + О2⇄2NО
Присутствие катализаторов только ускоряет или замедляет наступление равновесия, оно не вызывает его смещения и не меняет значения константы равновесия.
Пример 1. При каких изменениях температуры, давления и концентраций начальных и конечных продуктов можно уменьшить выход хлора в реакции
СО + Cl2 ⇄ СОCl2, ∆Н<0,
Напишите уравнение константы равновесия этой реакции.
Согласно принципу Ле Шателье, чтобы уменьшить выход хлора в реакции нужно, чтобы скорость прямой реакции была выше, чем скорость обратной. Для этого надо уменьшить температуру, т.к. прямая реакция экзотермическая, увеличить давление, т.к. в прямой реакции из 2 молей газов получается 1 моль газа, и увеличение внешнего давления увеличит скорость прямой реакции. Так же нужно увеличить концентрации начальных веществ и уменьшить концентрацию продукта реакции.
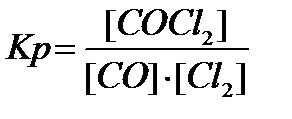
Контрольные вопросы
1. Что такое скорость химической реакции?
2. Перечислите факторы, от которых зависит скорость химической реакции.
3. Приведите закон действующих масс. Для каких реакций он выполняется?
4. Особенности кинетики гетерогенных процессов.
5. Что такое катализ? В чем состоит отличие гомогенного и гетерогенного катализа?
6. В чем заключается теория промежуточных соединений П. Сабатье?
7. Приведите формулу, отражающую правило Вант-Гоффа.
8. Поясните смысл состояния химического равновесия.
9. Принцип Ле Шателье. Приведите примеры.
10. Как надо изменить
1) давление;
2) температуру;
3) концентрацию водорода в системе N2(г)+ 3H2(г)«2NH3(г); DН < 0,
чтобы увеличить выход аммиака?
 3. ХИМИЯ РАСТВОРОВ
3. ХИМИЯ РАСТВОРОВ
Цель раздела: формирование основных понятий о растворах, о законах, связанных с процессами, протекающими в растворах, раскрытие роли растворов в жизни человека, в общеинженерной подготовке бакалавра.
 2020-06-10
2020-06-10 191
191








