Скорость и механизмы химических реакций изучает химическая кинетика. Знание законов химической кинетики позволяет регулировать скорость реакции, то есть управлять химическим процессом. Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. Для гомогенных реакций (протекающих в однородной среде) реакционным пространством является объем, а для гетерогенных (протекающих на границе раздела фаз) – поверхность раздела. Скорость химической реакции зависит от ряда факторов.
1. От природы реагирующих веществ, а именно, от внутримолекулярных (химических) и межмолекулярных (ван-дер-ваальсовых) сил. Наименее активно реагируют молекулы с прочной ковалентной связью, более активно – ионные соединения.
2. От агрегатного состояния реагирующих веществ. Наиболее быстро протекают реакции между веществами, находящимися в растворенном или газообразном состоянии, вследствие лучшего контакта между реагентами. Вещества, находящиеся в твердом или жидком состоянии, реагируют медленно вследствие малого контакта между ними, так как контакт имеет место лишь на поверхности соприкосновения реагентов.
3. От концентрации реагирующих веществ. Скорость реакции тем больше, чем больше концентрации реагирующих веществ, так как увеличивается число столкновений, сопровождающихся химическим взаимодействием атомов или молекул реагирующих веществ. Зависимость скорости реакции от концентрации и природы реагирующих веществ подчиняется закону действия масс (строго применяется для гомогенных реакций). При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов. Так, для реакции аА + bВ = сС
скорость выражается уравнением: 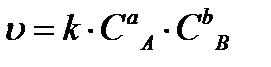 ,
,
где СА, СВ– молярные концентрации веществ А и В, моль/л;
a, b– стехиометрические коэффициенты (коэффициенты перед формулами веществ в уравнении реакции);
k – константа скорости реакции, зависящая от природы реагирующих веществ, температуры и катализатора
(k =υ, при 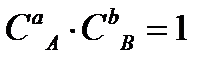 или при
или при 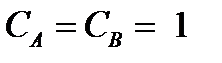 моль/л).
моль/л).
Формулируемый применительно к гетерогенным реакциям закон действия масс не учитывает концентрации веществ, находящихся в твердом состоянии (принято использовать следующие обозначения агрегатного состояния вещества: г – газообразное, ж - жидкое, т – твердое или к – кристаллическое; в очевидных ситуациях обходятся без этих обозначений). Так, если вещество А реагирует в твердом состоянии, то скорость реакции аА(Т) + вВ(Г) = сС(Г) зависит только от концентрации вещества В 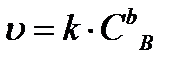 .
.
4. От давления.
Скорость реакции зависит от давления лишь в тех случаях, когда в реакции участвуют газообразные вещества, так как с изменением давления изменяются концентрации газообразных реагентов.
Пример 1. Как изменится скорость реакции N2(г) + 3H2(г) = 2NH3(г)
при увеличении давления системы в 2 раза?
Решение. При первоначальном давлении P1 уравнение, выражающее скорость, будет следующим:
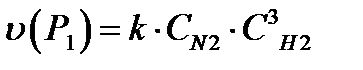
При повышении давления в 2 раза концентрация каждого вещества в газовой фазе возрастает в 2 раза, а скорость реакции увеличится в 16 раз: 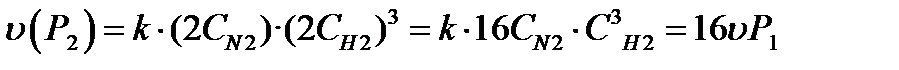
От температуры.
Изменение температуры оказывает сильное влияние на скорость реакции. Так как при изменении температуры концентрации реагентов не изменяются, то очевидно, что изменение скорости реакции связано с изменением константы скорости химической реакции.
Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа: при повышении температуры на каждые 100 скорость реакции (или константа скорости реакции) увеличивается в 2- 4 раза:
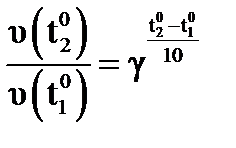
Где 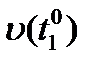 ,
, 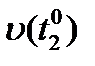 - скорости реакции при начальной
- скорости реакции при начальной 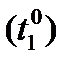 и конечной
и конечной 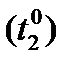 температурах;
температурах;
g- температурный коэффициент реакции, показывающий, во сколько раз увеличится (или уменьшится) скорость реакции (константа скорости реакции) при повышении (или понижении) температуры на каждые 100.
Возрастание скорости реакции с повышением температуры связано с увеличением числа реакционноспособных молекул реагирующих веществ.
Пример 2 Температурный коэффициент некоторой реакции равен 4. Как изменится скорость этой реакции при нагревании реакционной смеси от 20 до 500С?
По правилу Вант-Гоффа
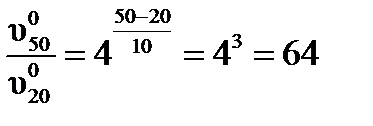
При нагревании реакционной системы от 200C до 500С скорость реакции возрастет в 64 раза.
От катализатора.
Скорость химической реакции можно изменить введением веществ, состав и количество которых к концу реакции остаются неизменными. Вещества, ускоряющие химическую реакцию, называются катализаторами. Замедлители химических реакций называются ингибиторами или отрицательными катализаторами. Катализ подразделяют на гомогенный и гетерогенный. При гомогенном катализе катализатор вместе с основными реагирующими веществами составляет одну фазу. При гетерогенном катализе катализатор образует самостоятельную фазу, и взаимодействие реагирующих веществ, протекает на поверхности этой фазы.
Для объяснения механизма гомогенного катализа наибольшее распространение получила теория промежуточных соединений, предложенная французским химиком Сабатье и развитая в работах Н.Д. Зелинского. Согласно этой теории катализатор реагирует с исходными веществами, образуя нестойкие промежуточные соединения, последующие превращения которых, приводят к образованию нужных продуктов реакции. Одна из причин, позволяющих катализаторам изменять скорость реакции, заключается в том, что катализатор создает новый путь протекания реакции, характеризующейся более низким барьером активации. Химическое взаимодействие катализатора с исходными веществами направляет реакцию по пути, отличному от того, что осуществляется в отсутствие катализатора. В результате этого уменьшается энергия активации протекающего взаимодействия и увеличивается его скорость. При отрицательном катализе энергия активации реакции возрастает, а скорость её уменьшается.
 2020-06-10
2020-06-10 1145
1145
