Стр. 55-58 11 класс
Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
По числу замещённых атомов водорода различают соответственно первичные (замещен один атом водорода), вторичные (замещены два атома водорода из трех) и третичные (замещены три атома водорода из трех) амины.
По числу NH2-групп в молекуле амины делят на моно амины, ди амины, три амины и так далее.
| Первичный амин | Вторичный амин | Третичный амин |

| 
| 
|
Номенклатура
К названию органических остатков, связанных с азотом, добавляют слово «амин» (группы упоминают в алфавитном порядке): CH 3 NHC 3 H 7 — метилпропиламин, CH 3 N (C 6 H 5)2 — метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода:
 2-аминопентан
2-аминопентан
Для некоторых аминов используются тривиальные названия: C 6 H 5 NH 2 — анилин (систематическое название — фениламин).
Химические свойства
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи. Азот предоставляет неподеленную электронную пару, исполняя роль донора. В качестве акцептора электоронов может выступать, например, протон Н+, образуя ион R3NH+. Возникшая ковалентная связь N-H полностью эквивалентна остальным связям N-H в амине.
· Взаимодействие с водой. Водные растворы аминов проявляют щелочную реакцию:

· Взаимодействуя с кислотами, амины образуют алкиламмониевые соли, в большинстве случаев растворимые в воде:

· Ацилирование. При нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов, соединений с фрагментом -С(О)N<:

Реакция с ангидридами протекает в мягких условиях. Ещё легче реагируют хлорангидриды, реакция проводится в присутствии основания, чтобы связать образующийся HCl.
Таким образом получают жаропонижающее средство — ацетанилид:

· Ароматические амины реагируют с галогенами по механизму электрофильного замещения в бензольном ядре. При галогенировании анилина бромной водой при комнатной температуре образуется триброманилин (в виде осадка белого цвета):

· Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом. При помощи азотистой кислоты первичные, вторичные и третичные амины отличают друг от друга. Из первичных аминов образуются первичные спирты:

При этом выделяется газ (азот). Это признак того, что в колбе первичный амин. Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения, содержащие фрагмент >N-N=O:

Третичные амины при обычной температуре в азотистой кислоте просто растворяются.
· При горении амин выделяет кроме воды и углекислого газа ещё и азот:
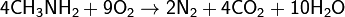
Получение
Восстановление нитросоединений — Реакция Зинина. Эту реакцию впервые осуществил Н. Н. Зинин в 1842 году. Действуя на нитробензол сульфидом аммония, он получил анилин:

Восстановление железом:

Восстановление водородом в присутствии катализатора и при высокой температуре:
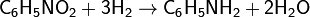
 Анили́н (фениламин) — органическое соединение с формулой C6H5NH2, простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Название «анилин» происходит от названия одного из растений, содержащих индиго — Indigofera anil (современное международное название растения — Indigofera suffruticosa).
Анили́н (фениламин) — органическое соединение с формулой C6H5NH2, простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Название «анилин» происходит от названия одного из растений, содержащих индиго — Indigofera anil (современное международное название растения — Indigofera suffruticosa).
Впервые анилин был получен в 1826 году при перегонке индиго с известью немецким химиком Отто Унфердорбеном (нем. Otto Unverdorben), который дал ему название «кристаллин».
В 1834 г. Ф. Pyнгe обнаружил анилин в каменно-угольной смоле и назвал «кианолом».
 В 1841 г. Ю. Ф. Фрицше получил анилин нагреванием индиго с раствором KOH и назвал его «анилином».
В 1841 г. Ю. Ф. Фрицше получил анилин нагреванием индиго с раствором KOH и назвал его «анилином».
В 1842 г. анилин был получен Н. Н. Зининым восстановлением нитробензола действием (NH 4)2S и назван им «бензидамом».
В 1843 г. А. В. Гофман установил идентичность всех перечисленных соединений.
Промышленное производство фиолетового красителя мовеина на основе анилина началось в 1856 году.
Получение
 В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50—60 °C, в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200—300 °C в присутствии катализаторов:
В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50—60 °C, в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200—300 °C в присутствии катализаторов:
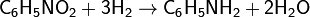
Впервые восстановление нитробензола было произведено с помощью железа:

Другим способом получение анилина является восстановление нитросоединений —реакция Зинина:

Химические свойства
Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок).
Анилин (аминобензол) применятся в производстве красителей, искусственных смол, текстильной и фармацевтической промышленности. Отравление анилином возможно при поступлении анилина в организм через рот, дыхательные пути и кожу. Накапливается в подкожной основе и паренхиматозных органах. Является метгемоглобинобразующим ядом, токсически влияет на центральную нервную систему, паренхиматозные органы.
Фридлиб Фердинанд Рунге - (1794 – 1867) - немецкий химик - органик.
 Важнейшие научные работы посвящены изучению органических соединений, в том числе алкалоидов и красителей. В 1819 году описал токсические свойства атропина и его способность расширять зрачок, выделил из коры хинного дерева хинин (за год до П. Ж. Пельтье и Ж. Б. Каванту). Исследовал цветочные пигменты и дубильные вещества. В 1831 году во время эпидемии холеры предложил использовать хлор в качестве дезинфицирующего средства (вместо уксуса и сернистого газа). В 1834 году выделил из каменноугольной смолы карболовую кислоту, пиррол, хинолин и анилин («кианол»); обнаружил, что окисление анилина приводит к образованию окрашенных продуктов. Получил из анилина действием хлорной извести синий краситель, а действием бихромата калия и серной кислоты — чёрный.
Важнейшие научные работы посвящены изучению органических соединений, в том числе алкалоидов и красителей. В 1819 году описал токсические свойства атропина и его способность расширять зрачок, выделил из коры хинного дерева хинин (за год до П. Ж. Пельтье и Ж. Б. Каванту). Исследовал цветочные пигменты и дубильные вещества. В 1831 году во время эпидемии холеры предложил использовать хлор в качестве дезинфицирующего средства (вместо уксуса и сернистого газа). В 1834 году выделил из каменноугольной смолы карболовую кислоту, пиррол, хинолин и анилин («кианол»); обнаружил, что окисление анилина приводит к образованию окрашенных продуктов. Получил из анилина действием хлорной извести синий краситель, а действием бихромата калия и серной кислоты — чёрный.
Автор трёхтомной монографии «Химия красителей» (1834—1850), учебника «Основы химии» (1846—1847).
 Никола́й Никола́евич Зи́нин (1812— 1880) — выдающийся русский химик-органик, академик Петербургской академии наук, первый президент Русского химического общества (РХО) (1868–1877).
Никола́й Никола́евич Зи́нин (1812— 1880) — выдающийся русский химик-органик, академик Петербургской академии наук, первый президент Русского химического общества (РХО) (1868–1877).
Зинин впервые получил бензоин конденсацией бензальдегида в присутствии цианистого калия и бензил окислением бензоина азотной кислотой. В 1842 году Зинин открыл реакцию восстановления ароматических нитропроизводных в ароматические амины действием сернистого аммония (Реакция Зинина). Синтезы Зинина послужили научной основой для создания промышленности синтетических красителей, взрывчатых веществ, фармацевтических препаратов, душистых веществ и др.
 Фрицше Юлий Фёдорович -(1808г. – 1871г.) - российский химик и ботаник.
Фрицше Юлий Фёдорович -(1808г. – 1871г.) - российский химик и ботаник.
Первые работы связаны с извлечением лекарственных веществ из растений. Последующие исследования относятся главным образом к области органической химии. Изучал (конец 1830-х) производные мочевой кислоты, пурпуровую кислоту и её соли; установил природу мурексида – аммониевой соли пурпуровой кислоты (1839). При разложении индиго выделил (1840) антраниловую кислоту и описал её распад с образованием углекислого газа и азотистого основания, которое назвал анилином. Установил, что окисление анилина приводит к образованию окрашенных соединений. Открыл (1858) реакцию пикриновой кислоты с ароматическими углеводородами, приводящую к образованию хорошо кристаллизующихся молекулярных соединений. Открыл (1858) карбазол в каменноугольном дёгте, выделил углеводороды антрацен (1857), ретен (1858) и фенантрен (1869). Открыл (1868) реактив, чувствительный на углеводороды, – β-динитроантрахинон (реактив Фрицше).
17. «Химия в строительстве» 11 класс
Кейс
Известняк, по-видимому, был первым строительным материалом, какой использовал человек. Из его плит сооружены египетские пирамиды и Великая китайская стена. Наша столица Москва прозвана белокаменной именно потому, что многие ее здания возведены из известняка. Прочность кладки древних сооружений обеспечивалась идеальной подгонкой камней. (Вяжущие материалы тогда не применяли вовсе. Их научились приготавливать много позже.)
Бетон был изобретён ещё в Древнем Риме. Они изобрели бетон, который, застывая, приобретал прочность и долговечность камня.
Приходилось ли вам наблюдать, как разбирают старинные здания? Это очень нелегкое дело. Рабочие с превеликим трудом отламывают от стен кирпичи. Может быть, наши пращуры знали какой-нибудь секрет кладки? Нет. Оказывается, податливый, мягкий, как тесто, известковый раствор, которым скрепляли кирпичи, впитывает в себя углекислый газ из воздуха. Постепенно он становится тем же крепышом, каким был первоначально, - известняком. В современном строительстве известь почти не применяется. Во-первых, масса слишком долго твердеет; во-вторых, сохнет она недостаточно быстро; и в-третьих, прочность шва невелика.
Задания:
Составьте бизнес-проект по технической химии (презентацию). В Вашем распоряжении имеется сырье – известняк. Ваша задача – создать новое производство на имеющемся сырье, показать возможности создания других производств. Отразить применение, общие принципы и методы производства, схему производства (реакционный аппарат), указать химические реакции.
Слайды должны раскрыть содержание следующим образом:
o 1-ый слайд – Источник сырья, месторождение, доставка (карта, путь);
o 2-ой слайд – сырье, его подготовка, характеристика;
o 3-ий слайд - схема технологического процесса (упрощенная); принципы производства;
o 4-ый слайд – химические реакции (механизмы, если возможно);
o 5-ый слайд – аппараты, оборудование;
o 6-ой слайд – готовая продукция, характеристика;
o 7-ой слайд – применение готовой продукции;
o 8-ой слайд – проблемы охраны среды; техника безопасности;
o 9-ый слайд – исторические факты, персоналии, портреты (при возможности);
o 10-ый слайд – литературные источники, в том числе, ссылки на сайты.
 2020-07-12
2020-07-12 140
140








