Билет№1 1)Окислительно – восстановительные реакции. Электродный
Потенциал, ЭДС. Направленность окислительно – восстановительных
Реакций.
В настоящее время одна из самых общих классификаций реакций между неорганическими
соединениями исходит из того, что все реакции по своей сути являются донорно – акцепторными процессами и различаются природой частиц, которыми обмениваются исходные компоненты.
Различают окислительно – восстановительные и протолитические и реакции между комплексными соединениями.
Теория ОВР была разработана Л.В. Писаржевским (1914 г.). Сущность ОВР заключается в
переходе всех или части валентных электронов от восстановителя к окислителю. Основныеположения теории сводятся к следующему:
1.)Окислением называется процесс отдачи электронов атомом, молекулой или ионом. Степеньокисления при этом повышается. Al 0 - 3e→ Al 3+; Fe 0 - 2e→ Fe 2+; 2Cl - 2e→Cl2 0.2.)Восстановлением называется процесс присоединения электронов. Степень окисления при этом понижается. S 0 +2e→ S 2-; I 2 0 + 2e→ 2I -; Fe 3+ + 1e→ Fe 2+.
3.)Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются. Так как атомы, молекулы или ионы ходят в состав определенных веществ, то сами эти вещества называются окислителями или восстановителями.4.)Окисление всегда сопровождается восстановлением и, наоборот, восстановление связано с окислением. Так, если имеется окислитель, то обязательно должен быть и восстановитель. ОВР представляют собой единство двух противоположных процессов – окисления и восстановления.В ОВР строго соблюдается правило:Число электронов, отдаваемых восстановителем, равно числу электронов,присоединяемых окислителем.Таким образом, реакции, протекающие с изменением степени окисления элементарных частиц,входящих в состав реагирующих веществ, называются окислительно– восстановительными.
Электродный потенциал
Электро́дный потенциа́л — разность электрических потенциалов между электродом и
находящимся с ним в контакте электролитом (чаще всего между металлом и раствором
электролита).Электродный потенциал характеризует способность атома отдавать свои валентные электроны,т.е востановительную активность.Абсолютное значение найти нельзя. Абсолютное значение электродного потенциала найти нельзя. Находят относительные значения по отношению к водороду (эталон, стандарт). Е окисленная форма/восстановленная форма (В). Самостоятельно протекают ОВР, в которых восстановитель имеет более отрицательный электродный потенциал, чем окислитель. Знак и величина потенциала зависят от положения равновесия между металлом и раствором, природы металла, концентрации его ионов в растворе и температуры. Чем большей химической активностью обладает вещество, тем легче оно растворяется, тем в большей степени равновесие смещено вправо – тем отрицательнее потенциал. Переход ионов вещества в раствор происходит тем интенсивнее, чем меньше концентрация катионов в растворе. Наоборот, с увеличением концентрации раствора равновесие смещается влево, и потенциал становится более положительным. С повышением температуры потенциал становится более положительным, равновесие смещается влево. Ионы переходят в раствор – гидратация, а она процесс экзотермический (принцип Ле Шателье). Зависимость электродного потенциала от концентрации веществ, участвующих в ОВР, и от температуры выражается уравнением Нернста: 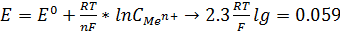
 . ОВР самопроизвольно протекает в сторону окислителя с меньшим значением стандартного электродного потенциала. Стандартный электродный потенциал является мерой окислительно-восстановительной способности в реакциях только в водных растворах.Потенциал, измеренный при стандартных условиях, называется стандартным электродным потенциалом (Е0). Величину Е 0 называют стандартным электронным потенциалом. Значения стандартного электронного потенциала (как и ∆G 0) растворенных веществ относят к 1М растворам, а для газообразных веществ – к 101325 Па. В качестве стандартной принимают температуру 25 0 С.Электродные потенциалы не являются неизменными. Они зависят от соотношения концентраций(точнее активностей) окисленной и восстановленной форм вещества, а так же от температуры,природы растворителя, рН среды и др.Зависимость значения электродного потенциала от концентрации окисленной и восстановленной форм и температуры описывается уравнением Нернста:, где Е0 –стандартный электронный потенциал процесса; R – универсальная газовая постоянная; Т –абсолютная температура; n – число молей, передаваемых в элементарном процессе электронов; F-число Фарадея; a Ox и a Red – концентрации окисленной и восстановленной форм.Направленность окислительно – восстановительных реакций.О направлении ОВР можно судить по изменению энергии Гиббса системы. Кроме того,для количественной характеристики окислительно-восстановительной активности веществ,находящихся в растворах или соприкасающихся с ними, используются так называемые электродные, или окислительно – восстановительные, потенциалы Е. Электродвижущая сила – разность электродных потенциалов окислителя и восстановителя. Это максимально возможная для данной системы разность потенциалов. Чем больше величина ЭДС, тем интенсивнее протекает ОВР.
. ОВР самопроизвольно протекает в сторону окислителя с меньшим значением стандартного электродного потенциала. Стандартный электродный потенциал является мерой окислительно-восстановительной способности в реакциях только в водных растворах.Потенциал, измеренный при стандартных условиях, называется стандартным электродным потенциалом (Е0). Величину Е 0 называют стандартным электронным потенциалом. Значения стандартного электронного потенциала (как и ∆G 0) растворенных веществ относят к 1М растворам, а для газообразных веществ – к 101325 Па. В качестве стандартной принимают температуру 25 0 С.Электродные потенциалы не являются неизменными. Они зависят от соотношения концентраций(точнее активностей) окисленной и восстановленной форм вещества, а так же от температуры,природы растворителя, рН среды и др.Зависимость значения электродного потенциала от концентрации окисленной и восстановленной форм и температуры описывается уравнением Нернста:, где Е0 –стандартный электронный потенциал процесса; R – универсальная газовая постоянная; Т –абсолютная температура; n – число молей, передаваемых в элементарном процессе электронов; F-число Фарадея; a Ox и a Red – концентрации окисленной и восстановленной форм.Направленность окислительно – восстановительных реакций.О направлении ОВР можно судить по изменению энергии Гиббса системы. Кроме того,для количественной характеристики окислительно-восстановительной активности веществ,находящихся в растворах или соприкасающихся с ними, используются так называемые электродные, или окислительно – восстановительные, потенциалы Е. Электродвижущая сила – разность электродных потенциалов окислителя и восстановителя. Это максимально возможная для данной системы разность потенциалов. Чем больше величина ЭДС, тем интенсивнее протекает ОВР. 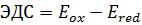 .
. 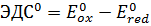 .ОВР протекает тогда, когда ЭДС>0. Направленность ОВ процесса определяется знаком ЭДС. Отрицательное значение ЭДС свидетельствует о том, что процесс слева направо протекать не может, реакция возможна только в обратном направлении. Стандартная ЭДС ОВР связана со стандартной энергией Гиббса, соотношением: z*F*ЭДС0=--G0.
.ОВР протекает тогда, когда ЭДС>0. Направленность ОВ процесса определяется знаком ЭДС. Отрицательное значение ЭДС свидетельствует о том, что процесс слева направо протекать не может, реакция возможна только в обратном направлении. Стандартная ЭДС ОВР связана со стандартной энергией Гиббса, соотношением: z*F*ЭДС0=--G0.
 2020-07-12
2020-07-12 218
218







