Архитектурно-строительный университет
Кафедра химии
ОТЧЕТЫ
по лабораторным работам по курсу
химии
Выполнил __________________ Н.И. Иванов
Проверил ___________________ И.И. Петров
г. Нижний Новгород – 2002

Лабораторная работа № 1
«Определение молярной массы магния»
Цель работы
Определить молярную массу металлического магния по его реакции с соляной кислотой. Сравнить полученное экспериментальное значение с теоретическим и вычислить ошибку эксперимента.
Теоретическая часть
Молярная масса (М) – величина, равная отношению массы вещества к его количеству. 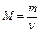 [г/моль], т.е. это масса одного моля. Моль – количество вещества, содержащее
[г/моль], т.е. это масса одного моля. Моль – количество вещества, содержащее 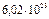 (число Авогадро) структурных единиц (атомов, молекул, ионов и т.д.). Молярная масса численно равна относительной молекулярной массе (Мrelativ), вычисленной по таблице Д.И. Менделеева.
(число Авогадро) структурных единиц (атомов, молекул, ионов и т.д.). Молярная масса численно равна относительной молекулярной массе (Мrelativ), вычисленной по таблице Д.И. Менделеева.
Например: 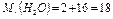
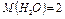 г/моль.
г/моль.
Реакция магния с соляной кислотой протекает по уравнению:
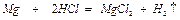
1моль 2моля 1моль 1моль
при этом: 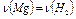 (1), т.е.
(1), т.е.  (2)
(2)
т.к. 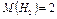 г/моль
г/моль
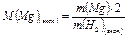 (3)
(3)
Для определения молярной массы магния навеску металла взвешивают на аналитических весах с точностью 0.0001 г. и растворяют в избытке HCl. Выделяющийся газообразный водород собирают и вычисляют его массу по уравнению Менделеева – Клайперона.
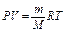 (4)
(4)
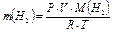 (5)
(5)
Затем по уравнению (3) вычисляют экспериментальное значение молярной массы магния.
Экспериментальная часть
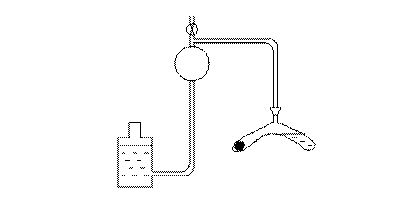
Опыт проводится в установке, схема которой приведена на рисунке.
 |
5
3
2
1
4
Mg HCl
Рис. Схема установки
1 – реакционный сосуд; 2 – пробка с резиновым шлангом; 3 – мерная бюретка с калиброванным шаром; 4 – уравнительная склянка с водой; 5 – кран сообщения с атмосферой
Ход работы:
1. В малое колено реакционного сосуда поместить навеску магния (например, 0, 2570 г.).
2. В большое колено осторожно по стенке налить 15 мл 15% раствора HCl.
3. Удерживая сосуд горизонтально закрыть его пробкой 2.
4. При открытом кране 5 поднять уравнительную склянку с водой 4 и установить уровень воды в мерной бюретке к нулевому делению (верхний обрез шара).
5. Закрыть кран 5, опустить уравнительную склянку на стол и проверить герметичность прибора. За 1 минуту уровень воды в бюретке не должен заметно опускаться.
6. Осторожно наклонить реакционный сосуд и по каплям приливать кислоту к магнию. Наблюдать бурное выделение водорода и вытеснение воды из мерной бюретки.
7. По окончании реакции передвигать уравнительную склянку вдоль шкалы бюретки до совпадения уровней воды и записать объем выделившегося водорода (например, 312 мл).
8. Разобрать прибор, промыть реакционный сосуд дистиллированной водой.
Пример расчета экспериментального значения молярной массы магния
Исходные данные:
m (Mg) = 0,2570 г.
Р = 731 мм рт.ст. (по барометру).
Т = 298 К (25°С по термометру).
R = 8,31 Дж/моль∙К.
По уравнению Менделеева-Клайперона масса водорода равна:
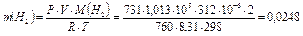 г
г
Экспериментальная молярная масса магния равна:
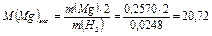 г/моль
г/моль
Теоретическая молярная масса магния по таблице Менделеева равна
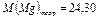 г/моль
г/моль
Расчет ошибок эксперимента:
1. Абсолютная ошибка:
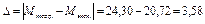 г
г
2. Относительная ошибка:
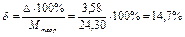
Выводы:
1. Экспериментально определено значение молярной массы магния, равное 20,72 г/моль.
2. Относительная погрешность составила 14,7 %.
Лабораторная работа № 2
«Химическое равновесие»
Цель работы
Определить направление смещения химического равновесия для реакций, протекающих в жидкой и газообразной фазе.
Теоретическая часть
В природе лишь ограниченное число процессов (химических реакций) протекает необратимо. В зависимости от условий многие химические реакции могут протекать как в прямом, так и в обратном направлении. Это означает, что исходные вещества не могут на 100% превратиться в продукты реакции, так как последние взаимодействуют между собой с образованием тех же исходных веществ. Такие реакции, называемые обратимыми, заканчиваются установлением химического равновесия, когда в системе присутствуют в той или иной концентрации все участники реакции. В состоянии равновесия в системе скорости прямой и обратной реакции равны, не происходит изменения концентраций реагентов и термодинамических функций состояния системы  .
.
Соотношение концентраций в равновесной системе характеризуется величиной, называемой константой равновесия.
Например, для гомогенной реакции синтеза аммиака
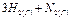
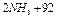 кДж (1)
кДж (1)
константа равновесия запишется:
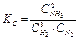 ;
;
Константа равновесия для каждой химической реакции имеет свое численное значение, которое не зависит от абсолютного значения концентраций, давления газообразных веществ или наличия в системе катализаторов. Однако К существенным образом зависит от температуры
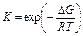
Химическое равновесие, установившееся при определенных условиях (Р, Т, С), может поддерживаться как угодно долго, если условия не изменяются. При изменении условий (одного или сразу нескольких) равновесие смещается в сторону либо прямой, либо обратной реакции и устанавливается новое состояние равновесия.
Направление смещения равновесия определяется на основании принципа Ле-Шателье: «Если на равновесную систему оказать внешнее воздействие (изменить Р, Т, С), то равновесие сместится в сторону той реакции (прямой или обратной), которая частично компенсирует внешнее воздействие».
Например, для реакции (1) увеличение 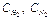 приводит к смещению равновесия в сторону прямой реакции, увеличение
приводит к смещению равновесия в сторону прямой реакции, увеличение 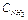 - в сторону обратной реакции. Нагревание равновесной смеси приводит к частичному разложению аммиака, то есть равновесие смещается в сторону обратной реакции, которая является эндотермической. Повышение общего давления в данной системе должно частично компенсироваться протеканием процесса, идущего с уменьшением числа молей газов, то есть равновесие смещается в сторону прямой реакции.
- в сторону обратной реакции. Нагревание равновесной смеси приводит к частичному разложению аммиака, то есть равновесие смещается в сторону обратной реакции, которая является эндотермической. Повышение общего давления в данной системе должно частично компенсироваться протеканием процесса, идущего с уменьшением числа молей газов, то есть равновесие смещается в сторону прямой реакции.
Экспериментальная часть
Опыт 1. Обменная реакция между раствором хлорного железа и раствором роданида аммония сопровождается изменением окраски раствора.
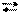
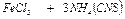
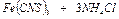
(р-р) (р-р) (р-р) (р-р)
слабожелтый бесцветный интенсивно- бесцветный
- красный
При этом в реакционном сосуде устанавливается химическое равновесие, для которого константа равновесия имеет вид:
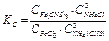
Ход работы:
1. В пробирку налить по 5мл 0,02 М растворов хлорного железа и роданида аммония, интенсивно встряхнуть. Раствор окрасится в темно-красный цвет.
2. Полученный раствор разлить в 4 пробирки. Первую пробирку оставить как эталон окраски.
3. Во вторую добавить 3-4 капли насыщенного раствора 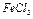 ; в третью – 3-4 капли насыщенного раствора
; в третью – 3-4 капли насыщенного раствора 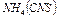 ; в четвертую – несколько кристаллов
; в четвертую – несколько кристаллов 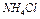 .
.
4. Результаты наблюдения занести в таблицу и сделать вывод о направлении смещения равновесия.
5. Раствор в 1-ой (эталонной) пробирке разбавить дистиллированной водой и сделать вывод о смещении равновесия в этом случае.
Таблица 1
Направление смещения равновесия
| № пробирки | Что добавлено | Изменения интенсивности окраски | Направление смещения равновесия |
| 1 | 
| уменьшение | нет смещения |
| 2 | 
| увеличение | 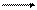
|
| 3 | 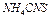
| увеличение | 
|
| 4 | 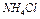
| уменьшение | 
|
Опыт 2. Смещение химического равновесия для реакций, протекающих в газовой среде.
Обратимая химическая реакция димеризации оксида азота в газовой фазе сопровождается значительным изменением окраски
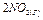
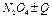
бурый бесцветный
Константа равновесия данной реакции имеет вид
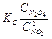
Так как данная реакция имеет довольно существенный тепловой эффект, то изменение температуры приводит к заметному изменению цвета газовой смеси.
Ход работы:
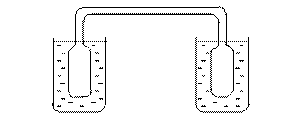
1. Взять стеклянный прибор (см. рис.), заполненный смесью 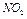 и
и 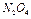 , находящихся в состоянии химического равновесия при комнатной температуре. Отметить одинаковую интенсивность окраски в обеих частях прибора.
, находящихся в состоянии химического равновесия при комнатной температуре. Отметить одинаковую интенсивность окраски в обеих частях прибора.
2. Поставить рядом два химических стакана: один – с горячей, а другой – с холодной водой.
3. Одновременно опустить прибор в оба стакана, наблюдать изменение окраски при охлаждении и нагревании смеси 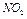 и
и 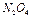 . Занести опытные данные в таблицу.
. Занести опытные данные в таблицу.
. . . . .
. .
. .
. .
.. ...
... ..
... ...
Рис. Прибор для исследования смещения равновесия в газовой среде.
Таблица 2
Смещение равновесия при изменении температуры газовой смеси
| Условия опыта | Окраска смеси | Концентрация
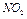
| Смещение равновесия |
| Т комнатная | одинаковая | исходная | - |
| Охлаждение | менее интенсивная | уменьшилась | 
|
| Нагревание | более интенсивная | увеличилась | 
|
Выводы:
1. Исследовано смещение равновесия для реакции в жидкой фазе.
2. Направление смещения равновесия в опыте 1 соответствует принципу Ле-Шателье.
3. Исследовано смещение равновесия при изменении температуры для реакции в газовой фазе.
4. При нагревании равновесие в опыте 2 смещается в сторону обратной реакции, т.е. прямая реакция является экзотермической, обратная - эндотермической.
Лабораторная работа № 3
«Скорость химических реакций»
Цель работы
Определить зависимость скорости химической реакции в жидкой фазе от концентрации реагирующих веществ.
Теоретическая часть
Скорость гомогенной химической реакции это изменение концентрации исходных веществ или продуктов реакции за единицу времени.
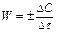 моль/л∙мин
моль/л∙мин
К важнейшим факторам, влияющим на скорость, относятся: концентрация, температура и наличие катализатора.
Влияние концентрации веществ на скорость реакции описывается законом действующих масс (кинетическим уравнением).
В общем виде для простой (элементарной) реакции
 аА+bB продукты реакции
аА+bB продукты реакции
уравнение имеет вид: 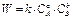
где k – константа скорости реакции, не зависящая от концентраций, но завися- щая от природы веществ, температуры и катализатора.
В данной работе изучается скорость реакции между раствором тиосульфата натрия и раствором серной кислоты.
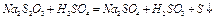
Данная реакция сопровождается выпадением в осадок элементарной серы, т.е. помутнением раствора. Время, которое проходит от момента сливания растворов до «начала помутнения» характеризует скорость данной реакции.
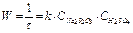
В наших опытах концентрацию серной кислоты будем поддерживать постоянной, а концентрацию соли изменять, разбавляя исходный раствор водой. Выражение для скорости реакции упрощается:
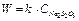
Математически скорость при изменении концентрации соли должна изменяться прямопропорционально по линейному уравнению типа 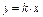 .
.
Экспериментальная часть
Опыт 1.
Ход работы:
1. В коническую колбу с помощью мерного цилиндра налить 12 мл раствора 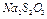 исходной концентрации.
исходной концентрации.
2. В отдельном мерном цилиндре приготовить 4 мл раствора 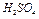 .
.
3. Быстро влить кислоту в колбу и включить секундомер.
4. Внимательно следить за реакцией, при появлении легкого помутнения выключить секундомер, записать время реакции (например, 20 сек.).
Опыт 2.
Ход работы:
1. В коническую колбу налить 8 мл исходной соли и 4 мл дистиллированной воды (разбавление 2: 1).
2-4. Аналогично опыту 1 (время реакции, например, 30 сек.).
Опыт 3.
Ход работы:
1. В коническую колбу налить 4 мл исходной соли и 8 мл воды (разбавление 1: 2).
2-4. Аналогично опыту 1 (время реакции, например, 60 сек.).
Результаты опытов занести в таблицу.
Таблица 1
Влияние концентрации тиосульфата натрия на скорость его реакции
с серной кислотой
| № опыта | Объем раствора, мл |
относи- тельная |
сек |
|
| ||
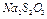
| 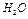
|
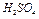
| |||||
| 1 | 12 | 0 | 4 | 3 | 20 | 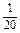
| 3 |
| 2 | 8 | 4 | 4 | 2 | 30 | 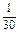
| 2 |
| 3 | 4 | 8 | 4 | 1 | 60 | 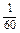
| 1 |
Например, в первом опыте помутнение началось через 20 сек., а в третьем – через 60 сек. Скорость реакции уменьшилась в 3 раза.
По данным таблицы построить график зависимости относительной скорости реакции от концентрации соли.
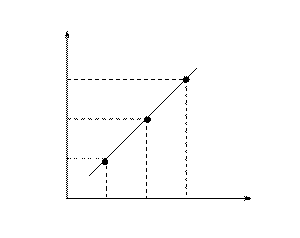 |
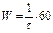
3
2
1
1 2 3 (относит.)
(опыт 3) (опыт 1)
Рис. Зависимость относительной скорости реакции от концентрации соли
Выводы:
1. Исследована зависимость скорости реакции от концентрации реагирующих веществ.
2. Для элементарной химической реакции эта зависимость является линейной, что соответствует кинетическому уравнению типа 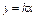
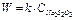 .
.
Лабораторная работа № 4
«Приготовление раствора соды заданной концентрации»
Цель работы
Основываясь на предварительных расчетах, путем разбавления водой 1%-ного раствора 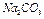 приготовить 200 мл раствора соды (
приготовить 200 мл раствора соды (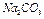 ) заданной концентрации. Титрованием установить точную концентрацию полученного раствора.
) заданной концентрации. Титрованием установить точную концентрацию полученного раствора.
Теоретическая часть
Растворы представляют собой жидкие диссоционные системы, образованные частицами растворителя, растворенного вещества и тех неопределенных, но экзотермических соединений, которые между ними образуются.
Образование растворов сопровождается выделением или поглощением теплоты (теплота растворения). При этом изменяются свойства, как растворяемого вещества, так и растворителя.
Истинные растворы представляют собой гомогенные многокомпонентные дисперсные системы с размером частиц дисперсной фазы менее 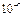 см (молекулы, ионы).
см (молекулы, ионы).
Растворитель это компонент, взятый в избытке, и агрегатное состояние которого сохраняет раствор.
Способность веществ растворяться количественно оценивают величиной растворимости. Растворимость некоторого вещества – это его концентрация в насыщенном растворе.
Коэффициент растворимости – число граммов растворенного вещества в насыщенном растворе, приходящееся на 100 г растворителя.
Молярная растворимость – количество моль растворенного вещества в одном литре растворителя.
Насыщенный раствор – раствор, находящийся в равновесии с растворенным веществом.
Величина взаимной растворимости веществ определяется их природой, а также внешними условиями (температура, давление).
Относительное содержание вещества в растворе называют концентрацией этого вещества. В зависимости от практического использования растворов применяют различные способы выражения концентрации:
Массовая доля (ω) – отношение массы растворенного вещества (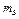 ) к массе раствора (
) к массе раствора (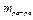 ).
).
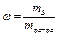
Массовый процент, процентная концентрация (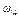 ).
).
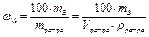 ,
,
где 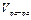 - объем раствора (мл),
- объем раствора (мл), 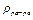 - плотность раствора (г/мл).
- плотность раствора (г/мл).
Молярная концентрация (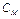 моль/л) – отношение числа моль растворенного вещества к объему раствора, выраженному в литрах.
моль/л) – отношение числа моль растворенного вещества к объему раствора, выраженному в литрах.
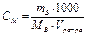 , моль/л
, моль/л
Эквивалентная (нормальная) концентрация (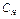 , экв/л) – отношение числа эквивалентов растворенного вещества к объему раствора, выраженному в литрах, т.е. число эквивалентов вещества в 1 л раствора.
, экв/л) – отношение числа эквивалентов растворенного вещества к объему раствора, выраженному в литрах, т.е. число эквивалентов вещества в 1 л раствора.
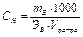 , экв/л
, экв/л
Экспериментальная часть
Предварительные расчеты:
Например, найти объем 1% раствора 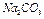 , необходимый для приготовления 200 мл (0,2 л) раствора с концентрацией
, необходимый для приготовления 200 мл (0,2 л) раствора с концентрацией 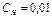 экв/л.
экв/л.
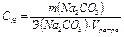
Рассчитаем 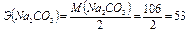 г/экв
г/экв
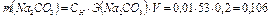 г
г
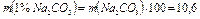 г.
г.
Так как 1%-ный раствор - сильно разбавленная система, примем его плотность равной 1 г/мл и вычислим объем.
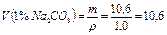 мл.
мл.
Ход работы:
1. Мерным цилиндром на 25 мл отобрать рассчитанный объем 1%-ного содового раствора (например, 10,6 мл).
2. Перенести пробу в мерную колбу объемом 200 мл и долить до метки дистиллированной водой.
3. Закрыть колбу пробкой, тщательно перемешать готовый раствор.
Установление точной концентрации полученного раствора
Для определения концентрации полученного раствора проводится титрование аналитической пробы раствором  с точно известной концентрацией
с точно известной концентрацией 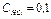 экв/л.
экв/л.
1. Пробу раствора отобрать пипеткой (например, 20 мл) и перенести в коническую колбу для титрования.
2. Добавить 2-3 капли индикатора «метилоранж», раствор окрасится в желтый цвет.
3. Из бюретки по каплям при постоянном перемешивании добавлять раствор HCl до резкого изменения цвета с желтого на оранжевый (точка эквивалентности).
4. Отметить объем кислоты, пошедшей на титрование. Опыт провести 3 раза, результаты усреднить.
Например: 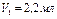
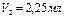
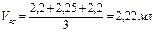
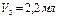
5. Рассчитать точную концентрацию содового раствора по формуле
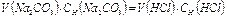
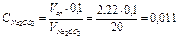 экв/л
экв/л
6. Расчет ошибок.
Абсолютная ошибка 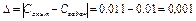
Относительная ошибка 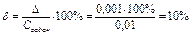
Выводы:
1. Из 1% раствора соды приготовлен раствор с концентрацией 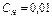 экв/л.
экв/л.
2. Установлена точная концентрация приготовленного раствора, равная 0,011 экв/л.
3. Относительная погрешность опыта составила 10%.
Лабораторная работа № 5
«Измерение водородного показателя некоторых растворов»
Цель работы
Определить характер среды в некоторых растворах, измерить водородный показатель (рН) с помощью индикатора и рН-метра.
Теоретическая часть
Вода является очень слабым электролитом, диссоциирующим на ионы водорода и гидроксил-ионы

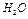
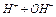
В чистой воде концентрация этих ионов равна и составляет 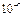 моль/л каждого. Константа диссоциации
моль/л каждого. Константа диссоциации
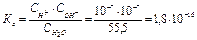
В любых водных растворах произведение 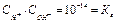 является постоянным и называется ионное произведение воды
является постоянным и называется ионное произведение воды 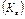 . Водородный показатель (рН) – это отрицательный десятичный логарифм концентрации ионов водорода
. Водородный показатель (рН) – это отрицательный десятичный логарифм концентрации ионов водорода
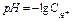
Если 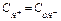 - среда нейтральная,
- среда нейтральная, 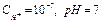 ;
;
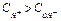 - среда кислая,
- среда кислая, 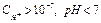 ;
;
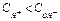 - среда щелочная,
- среда щелочная, 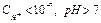 ;
;
Известны вещества-индикаторы, которые меняют окраску в зависимости от характера среды. Например, лакмус имеет красную окраску в кислой среде (рН<7) и синюю в щелочной (pH> 7).
Промышленность выпускает универсальную индикаторную бумагу, пропитанную смесью индикаторов, цвет которой изменяется в интервале рН= 2÷12. более точно рН измеряют специальными приборами – рН-метрами.
Экспериментальная часть
Для измерения рН приготовлены девять растворов электролитов (кислот, оснований и солей) с одинаковой молярной концентрацией 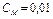 моль/л. Измерение рН проводим на рН-метре и контролируем индикаторной бумагой.
моль/л. Измерение рН проводим на рН-метре и контролируем индикаторной бумагой.
Ход работы:
1. Включить рН-метр.
2. Настроить прибор по буферному раствору с точным значением рН.
3. Измерить рН дистиллированной воды.
4. Вынув электроды из сосуда с дистиллированной водой, просушить их кусочком фильтровальной бумаги. Сухие электроды погрузить в раствор HCl. Измерить значение рН.
5. Вынуть электроды из раствора, промыть поверхность электродов дистиллированной водой из промывалки над стаканом. Вновь просушить фильтровальной бумагой. Сухие электроды погрузить в раствор 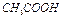 .
.
Аналогичные операции повторить со всеми растворами.
6. После измерения рН последнего раствора электроды промыть и погрузить в сосуд с дистиллированной водой. Выключить прибор из сети.
7. Результаты занести в таблицу.
8. Рассчитать по полученным значениям рН концентрацию ионов 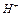 в каждом растворе. Результаты занести в таблицу.
в каждом растворе. Результаты занести в таблицу.
9. Записать уравнения реакций, объясняющих характер среды в исследуемых реакциях.
| Электролит С=0.01 моль/л | рН приб. | рН инд. | 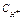
| Ионное или молекулярное уравнение |
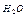
| 7,1 | 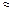 7 7
| 10-7,1 | 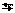 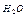 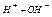
|
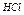
| 2 | 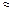 2 2
| 10-2 | 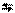 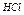 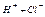
|
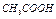
| 3,3 | 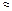 3 3
| 10-3,3 | 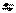 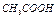 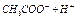
|
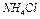
| 5,6 | 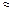 5 5
| 10-5,6 | 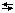 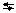 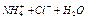 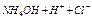
|
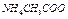
| 6,8 | 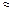 7 7
| 10-6,8 | 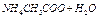 = = = = 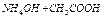
|
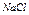
| 6,9 | 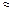 7 7
| 10-6,9 | 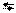 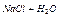 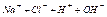
|
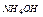
| 10,6 | 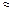 10 10
| 10-10,6 | 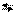 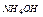 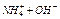
|
| 10,95 |  11 11
| 10-10,95 | 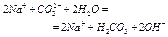
|
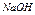
| 12,15 | 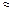 12 12
| 10-12,15 | 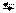 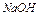 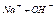
|
Выводы:
1. Установлено, что в растворах
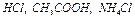 - среда кислая;
- среда кислая;
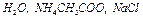 - нейтральная;
- нейтральная;
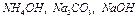 - щелочная.
- щелочная.
2. рН растворов кислот 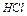 и
и 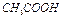 (соляной и уксусной) резко отличаются друг от друга при одной и той же концентрации электролита 0,01 моль/л. Это объясняется тем, что уксусная кислота продиссоциировала только на 4,3%; рН растворов
(соляной и уксусной) резко отличаются друг от друга при одной и той же концентрации электролита 0,01 моль/л. Это объясняется тем, что уксусная кислота продиссоциировала только на 4,3%; рН растворов 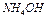 и
и 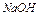 так же отличаются, поскольку в растворе гидроксид аммония диссоциирует на 4,2%; соли
так же отличаются, поскольку в растворе гидроксид аммония диссоциирует на 4,2%; соли 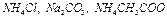 в растворах подвергаются гидролизу, характер среды определяется более сильной кислотой или основанием.
в растворах подвергаются гидролизу, характер среды определяется более сильной кислотой или основанием.
Лабораторная работа № 6
«Исследование скорости коррозии цинка в соляной кислоте»
Цель работы
Определить скорость коррозии в соляной кислоте чистого цинка и цинка в составе гальванической пары цинк-медь.
Теоретическая часть
При взаимодействии цинка с соляной кислотой окислительно-восстановительная реакция протекает по схеме:
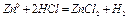
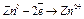 - окисление (анодный процесс).
- окисление (анодный процесс).
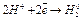 - восстановление (катодный процесс).
- восстановление (катодный процесс).
В случае чистого цинка оба эти процесса протекают одновременно в каждой точке на поверхности металла и в значительной степени «мешают» друг другу. При контакте цинка с менее активным металлом (например, Cu, Au, Ag и т.д.) происходит образование коррозионного гальванического элемента. Анодный окислительный процесс протекает на поверхности цинка, а катодное восстановление ионов водорода – на поверхности второго металла. Разделение анодного и катодного процесса значительно увеличивает общую скорость реакции.
Экспериментальная часть
О скорости растворения (коррозии) цинка в соляной кислоте удобно судить по количеству водорода, выделяющегося в единицу времени.
 |
4
3
2 5
1
Рис. Схема установки для исследования коррозии металлов
1 – реакционный сосуд; 2 – пробка с резиновым шлангом; 3 – мерная бюретка; 4 – кран для подъема воды в бюретку; 5 – емкость с водой
Ход работы:
Опыт 1
1. В малое колено реакционного сосуда поместить кусочек чистого металлического цинка.
2. В большое колено с помощью мерного цилиндра осторожно по стенке влить 25 мл 15% раствора HCl.
3. Удерживая реакционный сосуд горизонтально, закрыть его пробкой (2).
4. Надеть на носик крана (4) резиновую грушу в сжатом виде и поднять уровень воды в бюретке к нулевому делению шкалы.
5. Наклонить реакционный сосуд и сбросить кусочек цинка в кислоту. Наблюдать начало реакции; при проскоке первого пузырька водорода в бюретку включить секундомер.
6. В течение 3 минут через каждые 30 секунд отмечать уровень воды в бюретке; данные занести в таблицу.
7. Вынуть резиновую пробку (2), промыть реакционный сосуд водой.
Опыт 2
Взять кусочек цинка, предварительно обмотанный медной проволокой и проделать операции 1 – 7, как описано в опыте 1, результаты также занести в таблицу.
Например, получены данные:
Таблица
Зависимость объема выделившегося водорода от времени
| опыт | τ, мин | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 |
| 1 | 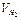 , мл , мл
| 3,5 | 8 | 12,8 | 17,5 | 22,0 | - |
| 2 | 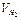 , мл , мл
| 5 | 12 | 16 | 21,5 | - | - |
По данным опытов 1 и 2 построить график зависимости объема выделившегося водорода от времени.
 |
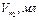
25 опыт 2
20
15 опыт 1
10
5
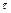 , мин
, мин
0 1 2 3
Рис. График зависимости объема выделившегося
водорода от времени
Из графика вычислить среднюю скорость выделения водорода как отношение 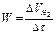 мл/мин
мл/мин
Например:
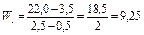 мл/мин
мл/мин
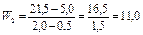 мл/мин
мл/мин
Пересчитать по уравнению химической реакции скорость выделения водорода на скорость растворения цинка в размерности г/мин.
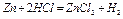
1 моль 1 моль
 65 г - - - - - - - - 22 400 мл
65 г - - - - - - - - 22 400 мл
х1 г - - - - - - - - - - - 9 мл 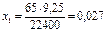 г/мин
г/мин
х2 г - - - - - - - - - - 12 мл 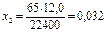 г/мин
г/мин
Выводы:
1. Исследована скорость коррозии цинка в соляной кислоте.
2. Показано, что в случае чистого цинка скорость коррозии составляет 0.027 г/мин.
3. В составе гальванической пары Zn-Cu скорость коррозии возрастает до 0,032 г/моль, т.е. примерно в 1,2 раза.
Лабораторная работа № 7
«Распознавание строительных материалов»
Цель работы
Используя сведения о физико-химических свойствах веществ, с помощью качественных химических реакций определить в четырех предложенных образцах следующие вещества: 1) гипс строительный 2) известняк (мел) 3) известь 4) портландцемент.
Теоретическая часть
Гипс строительный -  - тонко дисперсный порошок белого (серого) цвета, плохо растворимый в воде. В водном растворе диссоциирует
- тонко дисперсный порошок белого (серого) цвета, плохо растворимый в воде. В водном растворе диссоциирует
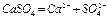
Характер среды – нейтральный, 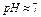 . Не реагирует с соляной кислотой. Характерным реагентом на ионы
. Не реагирует с соляной кислотой. Характерным реагентом на ионы 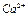 является оксалат аммония
является оксалат аммония
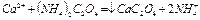
белый осадок
Ионы 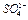 идентифицируются по реакции с хлоридом бария
идентифицируются по реакции с хлоридом бария
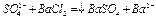
белый осадок
Известняк (мел) - 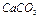 - порошок белого (серого) цвета, не растворимый в воде. Характер среды водной вытяжки нейтральный, рН =7. Характерной реакцией является взаимодействие с соляной кислотой, сопровождающееся бурным выделением газа
- порошок белого (серого) цвета, не растворимый в воде. Характер среды водной вытяжки нейтральный, рН =7. Характерной реакцией является взаимодействие с соляной кислотой, сопровождающееся бурным выделением газа 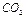 (вспенивание).
(вспенивание).
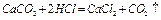
Известь негашеная – СаО, гашеная - 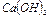 . Порошок белого (серого) цвета. При взаимодействии с водой негашеной извести протекает сильно экзотермическая реакция
. Порошок белого (серого) цвета. При взаимодействии с водой негашеной извести протекает сильно экзотермическая реакция
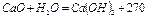 кДж/моль
кДж/моль
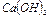 достаточно хорошо растворим в воде. «Известковая вода» имеет сильно щелочной характер среды, рН =9÷11.
достаточно хорошо растворим в воде. «Известковая вода» имеет сильно щелочной характер среды, рН =9÷11.
Сухой порошок 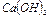 очень бурно реагирует с соляной кислотой, но без выделения газов (без вспенивания).
очень бурно реагирует с соляной кислотой, но без выделения газов (без вспенивания).
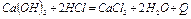
Для подтверждения наличия ионов 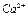 в водной вытяжке проводится качественная реакция с оксалатом аммония.
в водной вытяжке проводится качественная реакция с оксалатом аммония.
Портландцемент. В состав цемента входят следующие минералы:
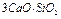 - 3-х кальциевый силикат (алит)
- 3-х кальциевый силикат (алит)
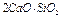 - 2-х кальциевый силикат (белит)
- 2-х кальциевый силикат (белит)
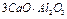 - 3-х кальциевый алюминат
- 3-х кальциевый алюминат
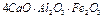 - 4-х кальциевый алюмоферрит (целит).
- 4-х кальциевый алюмоферрит (целит).
Портландцемент – серо-зеленый порошок, не растворимый в воде. Водная вытяжка за счет гидролиза силикатов кальция содержит 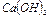 , имеет щелочной характер среды, рН =9÷10. Целит реагирует с соляной кислотой, при этом минералы разрушаются с образованием хлоридов кальция, алюминия и железа. Характерной реакцией на ионы
, имеет щелочной характер среды, рН =9÷10. Целит реагирует с соляной кислотой, при этом минералы разрушаются с образованием хлоридов кальция, алюминия и железа. Характерной реакцией на ионы 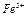 является реакция с роданидом аммония
является реакция с роданидом аммония
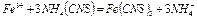
красное окрашивание
Опыты по распознаванию строительных материалов проводятся с водными вытяжками в пробирках и с сухими порошками на часовом стекле.
Экспериментальная часть
1. Приготовление водной вытяжки и определение характера среды.
В четыре пробирки поместить 0.1 – 0.2 г порошка, добавить ~5 мл дистиллированной воды, сильно встряхнуть. Дать отстояться 3 – 5 минут.
2. С помощью индикаторной бумаги определить рН в каждой пробирке. Например: № 1 – рН ≈ 7 – нейтральная среда;
№ 2 – рН ≈ 7 – нейтральная среда;
№ 3 – рН ≈ 10÷11 – щелочная среда;
№ 4 – рН ≈ 9÷10 – щелочная среда.
Водные вытяжки сохранить для дальнейших опытов.
3. Опыты с сухими порошками.
На 4 часовых стекла шпателем поместить 0,5 – 1 грамм порошка и из пипетки нанести 3 – 5 капель раствора HCl. Наблюдать за реакцией. Например: № 1 – нет реакции;
№ 2 – бурная реакция, вспенивание;
№ 3 – бурная реакция без вспенивания;
№ 4 – есть реакция, слабое вспенивание, изменение цвета.
4. Из опытов 1 – 3 следует, что № 1 вероятно гипс, № 2 – известняк, № 3 – известь, № 4 – целит.
5. Водную вытяжку № 1 профильтровать, разлить в 2 чистые пробирки и проделать качественные реакции на 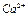 и
и 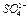 .
.
Выпадение белого осадка подтверждает, что в пробе № 1 находится 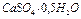 .
.
6. В пробе № 2 находится карбонат кальция 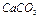 .
.
7. Водную вытяжку № 3 профильтровать, проделать качественную реакцию на 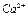 . Выпадение белого осадка доказывает наличие
. Выпадение белого осадка доказывает наличие 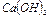 .
.
8. На часовое стекло с пробой № 4, где прошла реакция с соляной кислотой, добавить 2 – 3 капли роданида аммония. Появление красного окрашивания доказывает наличие ионов 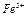 .
.
В пробе № 4 – портландцемент.
Выводы:
1. Методом химического анализа проведено распознавание строительных материалов.
2. Доказано, что образец № 1 – гипс (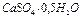 );
);
№ 2 – известняк (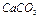 );
);
№ 3 – известь (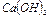 );
);
№ 4 – портландцемент.
Зеляев И.А.
Захарова О.М.
Митрофанова С.В.
ХИМИЯ
Часть II
Методические указания
для студентов I курса
(Направление «Строительство»)
ЛР № 020823 от 21.09.98
Подписано в печать___________ Бумага газетная.
Формат 60X90 1/16. Уч. изд. л. 0,9
Усл. печ.л. 1,1 Тираж экз. Заказ № _____
Нижегородский государственный архитектурно - строительный университет,
603950, Н. Новгород, Ильинская, 65
Полиграфцентр ННГАСУ, 603950, Н.Новгород, Ильинская, 65
 2020-07-12
2020-07-12 209
209
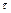 ,
,