ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ
МИКРО- И НАНОЭЛЕКТРОНИКИ.
Лабораторный практикум
Рекомендовано УМО по образованию в области информатики и радиоэлектроники в качестве пособия для специальностей
1-36 04 01 «Программно-управляемые электронно-оптические системы»,
1-39 03 01 «Электронные системы безопасности»,
1-39 02 02 «Проектирование и производство программно-управляемых электронных средств»,
1-39 02 01 «Моделирование и компьютерное проектирование радиоэлектронных средств»
Минск БГУИР 2015
УДК 621.3.049.77(076.5)
ББК 32.844.1Я73
Ф50
Р е ц е н з е н т ы:
кафедра микро- и нанотехники
Белорусского национального технического университета
(протокол № 3 от 26.11.2014);
декан физического факультета
Белорусского государственного университета,
доктор физико-математических наук, профессор В. М. Анищик
| Ф50 | Физико-химические основы микро- и наноэлектроники. Лабораторный практикум: пособие / А. П. Достанко [и др.]. – Минск: БГУИР, 2015. – 63 с.: ил. |
| ISBN 978-958-543-156-6. |
Включает лабораторные работы по изучению кинетики и механизмов термического окисления кремния и ионного распыления твердых тел, физических процессов в выпрямляющих контактах металл-полупроводник и в плазме тлеющего разряда, механизмов токопереноса и размерного эффекта в тонких металлических пленках.
Предназначен для закрепления и углубления теоретических знаний студентов, получения практических навыков при работе с измерительным и исследовательским оборудованием.
УДК 621.3.049.77(076.5)
ББК 32.844.1я73
ISBN 978-985-543-156-6 © УО «Белорусский государственный
университет информатики
и радиоэлектроники», 2015
СОДЕРЖАНИЕ
Лабораторная работа №1.ИССЛЕДОВАНИЕ МЕХАНИЗМА И КИНЕТИКИ ПРОЦЕССА ТЕРМИЧЕСКОГО ОКИСЛЕНИЯ КРЕМНИЯ …………………...4
Лабораторная работа №2 ИССЛЕДОВАНИЕ ВЫПРЯМЛЯЮЩЕГО
КОНТАКТА МЕТАЛЛ–ПОЛУПРОВОДНИК…………………………………...19
Лабораторная работа №3. ИССЛЕДОВАНИЕ МЕХАНИЗМА
И КИНЕТИКИ ПРОЦЕССА ИОННОГО РАСПЫЛЕНИЯ…………………….30
Лабораторная работа №4 ИССЛЕДОВАНИЕ ПЛАЗМЕННОГО
РАЗРЯДА В ВАКУУМНОЙ КАМЕРЕ………………………………………….43
Лабораторная работа №5. ИЗУЧЕНИЕ РАЗМЕРНОГО ЭФФЕКТА В ТОНКИХ МЕТАЛЛИЧЕСКИХ ПЛЕНКАХ…………………………………………………54
Лабораторная работа №1
ИССЛЕДОВАНИЕ МЕХАНИЗМА И КИНЕТИКИ ПРОЦЕССА ТЕРМИЧЕСКОГО ОКИСЛЕНИЯ КРЕМНИЯ
Цель работы: изучение механизмов роста оксидных пленок на поверхности кремния и определение кинетических характеристик процесса термического окисления.
теоретические сведения
В планарной технологии интегральных схем широко применяются оксидные пленки SiО2. Защита поверхности кремния при помощи SiO2 имеет определенные преимущества по сравнению с покрытиями из других диэлектрических материалов, таких как Si3N4, SiO.
Диоксид кремния SiO2 – диэлектрик универсального применения. В нем удачно сочетаются высокая химическая стойкость в окислительной среде, склонность к стеклообразованию, способствующая формированию бес-пористых пленок, удовлетворительные электрофизические свойства. Крайне важно, что SiO2 легко растворяется в плавиковой кислоте HF, обеспечивая тем самым возможность фотогравировки планарных структур. В то же время по отношению к смеси HF + НNОз пленка SiO2 практически стабильна, что позволяет использовать ее в качестве маски при селективном травлении кремния.
Одной из важнейших функций пленки диоксида кремния является маскирование поверхности кремниевой подложки от попадания на нее атомов примеси, что позволяет осуществлять диффузию только в те области, которые свободны от слоя SiO2. Защитные свойства слоя SiO2, препятствующего проникновению примеси, связаны с тем, что бор или фосфор, взаимодействуя при температурах диффузии с SiO2, образуют на его поверхности боро- и фосфоросиликатные стекла. Другой важной функцией, которую выполняют слои SiO2 на поверхности кремниевой подложки, является защита р-n- переходов, активных и пассивных элементов интегральной схемы. В результате этого стабилизируются их параметры, уменьшается влияние поверхности кремния на электрические характеристики элементов схемы. Кроме перечисленных применений, слои SiO2 служат изолирующим основанием для контактных площадок и проводящих коммутирующих металлических соединений.
Методы формирования оксидных слоев на кремнии можно разделить на две основные группы. К первой группе относятся методы, в основе которых лежит нанесение оксидов извне, когда кремний выполняет роль инертной подложки, ко второй – методы прямого окисления кремния, когда материал подложки является одним из компонентов химического взаимодействия.
К методам создания оксидных пленок на кремнии нанесением материала извне относятся термическое испарение и ионное распыление кремния в кислородной атмосфере, ионное распыление диоксида кремния, образование оксидной пленки при химическом взаимодействии в газовой фазе (пиролиз силана или кремнийорганических соединений в окислительной атмосфере, гидролиз галогенидов кремния).
К методам собственно окисления кремния относятся различные варианты термического окисления (обработка поверхности кремния в окислительной атмосфере при повышенных температурах), электрохимическое (анодное) оксидирование, а также окисление в кислородной плазме тлеющего разряда при относительно низких температурах (порядка 300–400 °С).
Термическое окисление кремния является одним из наиболее технологичных и широко применяемых на практике методов. Этот процесс проводят в различных окислительных средах: увлажненном кислороде, водяном паре при атмосферном и повышенном (до 500 атм.) давлении. Часто используют комбинированные режимы окисления. Иногда для ускорения термического окисления прибегают к использованию активаторов.
SiO2 может иметь различные кристаллические модификации или же находиться в стеклообразном (аморфном) состоянии – плавленый кварц. При термическом окислении кремния на его поверхности вырастает стеклообразный слой SiO2 (рис. 1.1). Точечные дефекты на поверхности Siили посторонние частицы при термическом окислении могут стать центрами кристаллизации. На них вырастают частицы в кристаллическом состоянии – кристобалиты.
Термическое окисление кремния может происходить при взаимо-действии с сухим кислородом, влажным кислородом и парами воды. В первом случае происходит реакция
Si + О2 → SiO2. (1.1)
В остальных идет следующая реакция:
Si + 2Н2О → SiО2 + 2Н2 . (1.2)

Рис. 1.1. Вид границы раздела монокристаллический
кремний–аморфный диоксид кремния
Природа этой реакции более сложна и ее следует рассматривать как многоступенчатую. На первом этапе водяные пары вступают в реакцию с ионами кислорода, связывающими кислородно-кремниевые тетраэдры в уже образовавшейся SiО2:
Н2О + (Si–О–Si) → (Si–ОН) + (ОН–Si). (1.3)
Гидроксильные группы, попадая на границу раздела SiО2–Si, вступают в реакцию с кремнием. В результате образуется окисел и водород:
(Si–ОН) (Si–О–Si)
+ Si–Si → +Н2. (1.4)
(Si–ОН) (Si–О–Si)
Водород в дальнейшем может вступать в реакцию с ионами кислорода в растущем оксиде. В результате опять будут возникать гидроксильные группы:
(О–Si) (ОН–Si)
Н2 + →← . (1.5)
(О–Si) (ОН–Si)
Такая многоступенчатая реакция способствует увеличению скорости окисления.
Термическое окисление проводят обычно при температуре 800–1250 °С. Процесс окисления состоит в диффузионном переносе кислорода через выращенный аморфный слой SiО2 (на поверхности кремния даже при комнатной температуре всегда находится слой естественного оксида толщиной 3–6 нм) и последующей реакции с Si на границе Si–SiО2. B принципе возможны два механизма роста слоя оксида на поверхности Si. В одном случае окислитель диффундирует сквозь слой к поверхности Si и там реагирует с ним, а в другом Si диффундирует наружу к поверхности окисла и вступает в реакцию с кислородом. Установлено, что второй из этих механизмов играет пренебрежимо малую роль. Качественно это можно объяснить тем, что для передвижения кислорода в окисле необходимо разорвать только две связи (≡Si–О–Si≡), а для передвижения Si, находящегося в центре тетраэдра из четырех ионов кислорода – четыре (рис. 1.2).
При термическом окислении на границе Si–SiО2 образуется переходный слой, обусловленный перераспределением кислорода. В исходной структуре на поверхности кремния присутствует хемосорбционный слой оксида, состав которого условно может быть выражен SiО2-х.

Рис. 1.2. Структура границы раздела кремний–диоксид кремния
Концентрация кислорода в этом слое падает от SiО2-х на поверхности Si до нуля на глубине. При окислении переходный слой формируется не на исходной поверхности подложки, а под ней за счет диффузионно-химических процессов. При этом граница раздела Si–SiО2 продвигается в объем кристалла. Вследствие этого в процессе термического окисления формирование граничного переходного слоя происходит в более «стерильных» условиях – во внутренних областях кристалла.
Описание кинетики окисления кремния базируется на основном соотношении Дила–Гроува:
 , (1.6)
, (1.6)
где d – толщина оксида;
t – время окисления;
А, В, τ – постоянные, зависящие от условий окисления.
Вышеуказанные постоянные можно определить по следующим формулам:
 ;
;  ;
;  , (1.7)
, (1.7)
где D – коэффициент диффузии окислителя в SiО2;
С* – концетрация окислителя в SiО2 у поверхности в момент достижения равновесия, т. е. при t → ∞;
N 1 – число молекул окислителя в единице объема оксида. Для окисления в сухом О2 – N 1 = 2,2·1022 см–3, а для окисления в парах воды – N 1 = 4,4·1022 см–3;
Кs – постоянная химической реакции окисления на поверхности Si;
h – коэффициент переноса массы.
Решение уравнения (1.6) примет вид
 . (1.8)
. (1.8)
Общий характер процесса окисления кремния может быть представлен кинетической кривой d = f (t) при Т = const (рис. 1.3). Условно кривая может быть разбита на четыре участка, для которых вид функции d = f (t) различен. Участок I, соответствующий начальному периоду окисления, описывается линейной функцией d = Kt. Скорость роста пленки на этом этапе постоянна и определяется стадией поверхностной реакции.
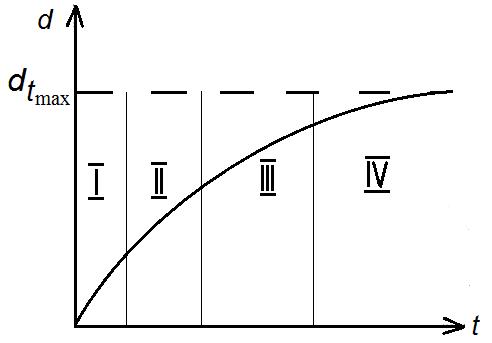
Рис. 1.3. Общий вид кинетической кривой термического
окисления кремния при постоянной температуре
Обычно эту стадию не наблюдают, т. к. поверхность Si уже покрыта тонким слоем оксида. По мере роста пленки все большую роль начинает играть диффузия окислителя к границе раздела Si–SiО2. Поэтому на участке II имеет место линейно-параболическая зависимость d 2 + cd = Kd (где c, К – константы), которая определяется соотношением поверхностной реакции и диффузии. Относительный вклад этих процессов определяется коэффициентом с. Преимущественно диффузионный тип процесса окисления осуществляется на участке III, для которого кинетическая кривая отражается параболическим законом, вытекающим из линейно-параболического при с = 0, т. е. при отсутствии вклада поверхностной реакции. При дальнейшем росте пленки диффузия кислорода через слой окисла затрудняется и скорость роста начинает убывать заметнее, чем на предыдущих участках. На участке IV кинетическая кривая приближается к некоторому предельному значению d max, характерному для данной температуры, и параболический закон сменяется параболически-логарифмическим d = K lg(1 + c 1 t) + c 2 t 1/2, а затем логарифмическим законом d = K lg ( 1 + c 1 t) при c 2 = 0. Таким образом, термическое окисление Si в технологически приемлемых интервалах температуры и времени выращивания приводит к образованию пленок предельной толщины. Так, при Т ~1200 °С невозможно получить термический SiО2 толщиной более 1,5 мкм.
Для практических целей интересны два предельных случая, вытекающих из соотношения (1.8). Если время велико (t >> A 2/4 B), то имеет место параболический закон окисления. Здесь В называется постоянной параболического закона окисления. Для малых времен (t << A 2/4 B) имеет место линейный закон d =Bt/A, где В/А – постоянная линейного закона окисления:
 . (1.9)
. (1.9)
Зависимость В от температуры определяется в основном температурной зависимостью коэффициента диффузии окислителя D в оксиде. На рис. 1.4 приведены экспериментальные результаты по определению температурной зависимости для окисления в сухом О2 и в парах воды. Окисление в кислороде характеризуется энергией активации 1,24 эВ, а окислению в парах воды соответствует энергия активации 0,71 эВ. Эти значения близки к энергиям активации для диффузии кислорода и паров воды через аморфную SiО2. Зная данные по коэффициентам диффузии, можно рассчитать значения для величины С*. Для О2 С* = 5·1016 см–3, а для Н2О – С* = 3·10 см–3. Эти величины близки к предельной растворимости кислорода и воды в аморфной SiО2 при атмосферном давлении.
Рассмотренная модель термического окисления справедлива, если окисление проводится в чистом сухом О2 или в чистых парах Н2О. На практике при термическом окислении часто используется смесь О2 и паров Н2О (увлажненный кислород). При этом скорость роста слоя может приближаться к высокой скорости роста в парах Н2О, характеризуемой более низкой энергией активации, а свойства слоя могут быть не намного хуже, чем при окислении в сухом О2.
Количественное рассмотрение процесса окисления во влажном O2 весьма сложно из-за большого числа возможных реакций в системе. При определенных условиях окисление во влажном О2 может быть описано параболическим законом:
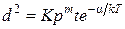 , (1.10)
, (1.10)
где К – постоянная;
р – давление водяных паров;
α – энергия активации;
m – величина, равная примерно 0,5 при высоком давлении водяных паров (0,2–0,5) от атмосферного давления) и 0,1–0,2 при более низком.

Рис. 1.4. Связь постоянной параболического
закона окисления с температурой
При практической реализации процесса окисления во влажном кислороде давление водяных паров обычно регулируется изменением температуры барботера, через который пропускается поток газа, содержащего кислород. Лучшие свойства окисла обеспечиваются при более низком давлении водяных паров (<0,15 атмосферного), которое достигается при температуре барботера ниже 60 °С.
Известно, что пленки SiО2, полученные в средах, содержащих воду, обладают худшими защитными свойствами и электрическими характе-ристиками, чем пленки SiО2, полученные в сухом О2. Поэтому в современной технологии производства интегральных схем (ИС) реализуется комбинированный режим выращивания оксида. Он предполагает чередование этапов окисления в сухом и влажном О2. Например, после окисления во влажном О2 проводится этап окисления в атмосфере сухого О2. При этом скорость роста и толщина слоя будут определяться в основном первым этапом. Во время второго этапа прежде всего происходит процесс удаления воды из слоя SiО2, а также незначительный рост толщин первичного слоя SiО2, заращивание имеющихся в нем пустот и различных дефектов.
На скорость протекания процесса термического окисления Si значи-тельное влияние оказывает легирование полупроводника донорными или акцепторными примесями. Влияние концентрации легирующей примеси на процесс термического окисления тесно связан с перераспределением примеси. Это влияние может быть обусловлено или изменением скорости реакции окисления на границе Si или же изменением коэффициента диффузии окислителя в слое. Экспериментально доказано, что если Si легирован бором, то при окислении бор стремится перейти из Si в оксид и поэтому растущий оксид обогащен бором. Коэффициент диффузии через такой слой растет. Поэтому кремний, сильно легированный бором, окисляется быстрее высокоомного Si. Это характерно как для высоких температур окисления, где справедлив параболический закон роста, так и для более низких температур, где выполняется линейный закон роста. В случае легирования фосфором кремний не имеет тенденции переходить в слой оксида, поэтому коэффициент диффузии окислителя в таком слое незначительно отличается от обычного нелегирован-ного SiО2. Однако наличие фосфора в Si увеличивает скорость химической реакции на его поверхности. Поэтому Si, сильно легированный фосфором, при Т < 1100 °С окисляется быстрее, чем высокоомный Si (т. к. при низких температурах скорость окисления определяется реакцией на поверхности Si). Особенно резко это отличие заметно при 600–700 °С. При Т > 1100 °С увеличение скорости роста оксида на Si, легированном фосфором, практически незаметно.
На скорость термического окисления влияют не только примеси, содержащиеся в кремниевой подложке, но и примеси в растущем слое оксида, в первую очередь, примеси ионов ОН– и Nа+. Присутствие Nа на границе раздела Si–SiО2 может приводить к каталитическому действию в процессе реакции окисления Si. Это действие сильнее сказывается в присутствии ионов гидроксила (т. е. при окислении в парах Н2О или во влажном кислороде), однако и при окислении в сухом О2 присутствие ионов Nа у поверхности Si ускоряет реакцию.
Ориентация Si также влияет на скорость его окисления, однако только при толщине SiО2 более 10 нм. Разница в скорости роста окисла при разной ориентации кристалла максимальна (40 %) при относительно низких температурах (700 °С) и постепенно уменьшается с ростом температуры при (1200 °С). Обычно окисление при ориентации (111) происходит быстрее, чем при ориентации (100).
На скорость процесса окисления влияет также давление окислителя. Преимущество окисления при высоком давлении (>105 Па) заключается в возможности снижения температуры процесса, что приводит к уменьшению перераспределения примеси и снижению числа дефектов в Si. С учетом эффекта давления пара выражение (1.7) для величины В может быть изменено в соответствии с законом Генри, гласящим, что равновесная концентрация атомов в твердом теле пропорциональна объемному давлению газа:
 , (1.11)
, (1.11)
где C* – максимальная концентрация окислителя;
Р – давление газа;
H – постоянный коэффициент Генри.
Тогда уравнение (1.7) примет вид
 . (1.12)
. (1.12)
Коэффициент А не зависит от давления пара, а его изменения связаны с ориентацией Si и концентрацией легирующей примеси. Существующее эмпирическое правило гласит, что каждому приращению давления на 105 Па соответствует снижение температуры окисления примерно на 30 °С. В соответствии с этим увеличение давления позволяет уменьшить температуру процесса окисления с 1100 до 800 °С без увеличения его продолжительности. При окислении под давлением 25·105 Па окисел толщиной 1 мкм может быть выращен за 15 мин при Т = 920 °С по сравнению с 10 ч при атмосферном давлении (105 Па).
Существенный прогресс в технологии термического окисления был достигнут при введении хлора в процесс окисления. Добавление Cl привело к увеличению электрической прочности окисла и увеличению скорости окисления Si. Экспериментально установлено, что монотонное увеличение коэффициента В с ростом концентрации Cl связано с изменением эффективного коэффициента диффузии D. Увеличение концентрации НCl может создавать напряжения в решетке SiО2, вследствие чего облегчается диффузия окислителя через пленку.
 2020-07-12
2020-07-12 257
257







