г) увеличение концентрации продукта реакции с течением времени
45. Численное значение константы химического равновесия характеризует:
а) состав равновесной смеси веществ и выход продукта обратимой реакции;
б) скорость реакции при наступлении равновесия;
в) скорость разложения исходных веществ;
г) скорость реакции при концентрации реагирующих веществ равных 1 моль/л.
46. Если константа химического равновесия намного больше единицы (например, К=2·103) то можно сказать, что:
а) равновесие обратимой реакции сильно смещено в сторону исходных веществ;
б) выход продуктов обратимой реакции мал;
в) константа скорости обратной реакции намного больше константы скорости прямой реакции;
Г) равновесие обратимой реакции сильно смещено вправо и выход продуктов реакции большой
47. Действие какого фактора никогда не вызывает смещение химического равновесия любой обратимой реакции:
а) изменение температуры;
б) изменение давления;
в) изменение концентрации исходного вещества;
Г) введение в систему катализатора
48. Укажите выражение, которое дает правильное соотношение между константами равновесия КР и КС:
а)  ; б)
; б)  ; в)
; в) 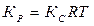 ; г)
; г) 
49. Рассчитайте константу равновесия реакции N2O4(г) ↔ 2NO2(г), если при наступлении равновесия концентрации NO2 и N2O4 соответственно равны 0,2 моль/л и 0,01 моль/л:
а) 20,0; б) 4; в) 0,05; г) 0,25
50. Используя уравнение изобары химической реакции  указать зависимость Кр от температуры, если ΔН обратимой реакции больше нуля:
указать зависимость Кр от температуры, если ΔН обратимой реакции больше нуля:
а) с увеличением температуры значение Кр уменьшается;
б) с увеличением температуры значение Кр увеличивается
в) с уменьшением температуры значение Кр увеличивается;
г) константа равновесия Кр от температуры не зависит
 2020-07-12
2020-07-12 335
335








