г) скорости реакции от энергии активации
105. Физический смысл константы скорости химической реакции заключается в том, что она равна скорости реакции, если концентрации реагирующих веществ:
а) равны между собой, но не равны единице; в) не равны между собой;
б) равны между собой и равны единице; г) не равны нулю.
106. Как скорость реакции, так и константа скорости зависят от:
а) температуры реакции; в) времени реакции;
б) концентрации реагирующих веществ; г) формы реакционного сосуда.
107. В каких единицах может выражаться скорость химической реакции:
а) моль×л-1×с-1; б) л×моль-1; в) с×моль-1; г) моль×л-1×мин
108. За время, равное 10 с, концентрация вещества А изменилась от 3,10 до 3,05 моль/л. Среднее значение скорости реакции по веществу А равно:
а) 0,003 моль·л –1·с –1; в) 0,005 моль·л –1·с –1;
б) 0, 300 моль·л –1·с –1; г) 0,500 моль·л –1·с –1
109. Для реакции А(ТВ) + В(Ж) = АВ(ТВ) укажите кинетическое уравнение:
а)  ; б)
; б)  ; в)
; в)  ; г)
; г) 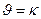
110. Уравнение 
 справедливо для реакции:
справедливо для реакции:
а) А2(г) + В(г) → D(г); в) 2А(тв) + В2(г) → D(г);
б) 2А(г) + В(тв) → D(г); г) 2А(г) + В(г) → D(г)
111. Укажите уравнение, используемое для расчета по молекулярности скорости прямой реакции в системе 4НС1(г)+О2(г) ↔ 2С12(г)+2Н2О(ж):
а)  ; б)
; б)  ; в)
; в)  ;
; 
112. Укажите уравнение, используемое для расчета по молекулярности скорости прямой реакции в системе СО(г) + Сl2(г) ↔СОСl2(г);
а)  ; б)
; б)  ; в)
; в)  ; г)
; г) 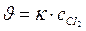
113. Скорость реакции 2СО(г) + О2(г) → 2СО2(г) при увеличении давления в системе в два раза:
а) увеличивается в 2 раза; в) увеличивается в 8 раз;
б) уменьшается в 2 раза; г) уменьшается в 8 раз
114. Скорость реакции не зависит от концентрации реагирующих веществ для реакций следующего порядка:
а) первого; б) нулевого; в) дробного; г) второго.
115. Константу скорости реакции первого порядка можно найти, построив график зависимости:
а) С = f (t); б) 1/С = f (t); в) ln С = f (t); г) С = f (1/t).
116. Укажите кинетическое уравнение для реакции первого порядка:
а)  ; б)
; б) 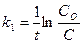 ; в)
; в)  ;
; 
117. Период полупревращения это промежуток времени, в течение которого:
а) концентрация продукта реакции уменьшается в 2 раза;
б) концентрация исходного вещества уменьшается в 2 раза;
в) концентрация продукта реакции в 2 раза превышает концентрацию исходного вещества;
г) концентрация исходного вещества в 2 раза превышает концентрацию продукта реакции.
118. Период полупревращения не зависит от начальной концентрации вещества для реакций следующего порядка:
а) первого; б) второго; в) дробного; г) третьего.
119. Укажите кинетическое уравнение для реакций второго порядка при равенстве концентраций исходных веществ:
а) 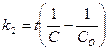 ; б)
; б)  ; в)
; в)  ; г)
; г) 
120. Константу скорости реакции второго порядка можно найти, построив график зависимости:
а) 1/С = f (t); б) С = f (t); в) ln С = f (t); г) С = f (1/t)
121. Период полупревращения для реакций второго порядка можно рассчитать по формуле:
а)  ; б)
; б)  ; в)
; в)  ; г)
; г) 
122. Разложение N2О5 является реакцией первого порядка, константа скорости которой равна 0,002 мин–1 при 3000С. Для разложения 80% N2О5 необходимо (ответ дать с точностью до целого):
а) 805 мин; б) 81 мин; в) 8 мин; г) 20 мин
123. Образование фосгена по уравнению СО + СI2 = СОСI2 является реакцией второго порядка, константа скорости которой 0,180 мин–1·(кмоль/м3). Чему равна концентрация фосгена через 1 час, если начальная концентрация его 0,5 кмоль/м3 (ответ дать с точностью до сотых):
а) 0, 41 кмоль/м3; б) 0, 46 кмоль/м3; в) 0,48кмоль/м3; г) 0,43 кмоль/м3
124. Превращение органического вещества (реакция первого порядка) при 600С прошло за 10 мин на 75,2%. Константа скорости данной реакции равна (ответ дать с точностью до сотых):
а) 0,17 с –1; б) 0,02 с –1; в) 0,14 с –1; г) 0,01 с –1
125. В некоторой реакции первого порядка половина вещества распадается за 100с. Для разложения 0,8 части первоначального количества необходимо (ответ дать с точностью до целого):
а) 233 с; б) 180 с; в) 420 с; г) 350 с
126. За какой промежуток времени инвертируется 50% раствора сахара концентрацией 0,3 моль/дм3 (реакция второго порядка; константа скорости реакции данной реакции 0,055 дм3·моль–1·мин–1)) (ответ дать с точностью до целого):
а) 15 мин; б) 18 мин; в) 12 мин; г) 13 мин
127. Период полупревращения органического вещества (реакция первого порядка; константа скорости реакции 0,14 мин–1) равен (ответ дать с точностью до целого):
а) 3 минуты; б) 8 минут; в)1 минута; г) 5 минут
128. Скорость реакции при повышении температуры на 200С (температурный коэффициент скорости реакции равен 3):
а) увеличивается в 3 раза; в) уменьшается в 3 раза;
б) увеличивается в 9 раз; г) увеличивается в 6 раз
129. При 1300С реакция заканчивается за 60 секунд (температурный коэффициент равен 2). Время (в секундах) окончания реакции при 1500С составит:
а) 15; б) 30; в) 20; г) 240
130. При 1300С реакция заканчивается за 60 секунд (температурный коэффициент равен 2). Время (в секундах) окончания реакции при 1100С составит:
а) 200; б) 120; в) 15; г) 240
131. Температурный коэффициент скорости реакции равен 2. При повышении температуры от 10 до 30°С скорость реакции, протекающей в газовой фазе, увеличится в:
а) 2 раза; б) 4 раза; в) 8 раз; г) 24 раза
132. Чему равен температурный коэффициент, если при нагревании реакционной смеси на 200С скорость реакции увеличилась в 9 раз:
а) 2; б) 3; в) 4; г) 5
133. При увеличении температуры на 300С скорость реакции возрастает в 8 раз. Температурный коэффициент реакции равен:
а) 1; б) 2; в) 3; г) 4
134. Как изменится скорость реакции при охлаждении реакционной смеси на 200С, если температурный коэффициент g равен 3:
а) уменьшится в 3 раза; в) увеличится в 3 раза;
б) уменьшится в 9 раз; г) увеличится в 9 раз.
135. Математическая запись уравнения Аррениуса выглядит следующим образом:
а) К(Т) = А·е ЕRT; б) К(T) = A· eE/RT; в) К(T) = A· e –E/RT; г) К(T) = A· e –ERT
136. С каким значением энергии активации химическая реакция протекает медленнее:
а) 30 кДж/моль; б) 100 кДж/моль; в) 90 кДж/моль; г) 40 кДж/моль.
137. При каком температурном коэффициенте энергия активации наибольшая:
а) 1; б) 2; в) 3; г) 4
138. Энергию активации можно найти, рассчитав константу скорости реакции при двух различных температурах и построив график зависимости:
а) ln К = f (Т); б) К = f (Т); в) ln К = f (lnТ); г) ln К = f (1/Т).
139. К вторичным фотохимическим реакциям относятся все реакции в ряду:
а) гидратация, сенсибилизация, диссоциация;
б) фосфоресценция, дезактивация, гидратация;
в) фосфоресценция, дезактивация, сенсибилизация;
г) дегидратация, флуоресценция, фосфоресценция
140. Квантовый выход фотохимической реакции равен:
а) отношению числа прореагировавших молекул к числу поглощенных квантов света;
б) числу квантов света, поглощенных в единицу времени;
в) отношению числа поглощенных квантов света к числу прореагировавших молекул;
г) числу квантов света, поглощенных активными частицами в единице объема системы.
141. В соответствии с законом светопоглощения Бугера–Ламберта–Бера оптическая плотность (D) равна:
а) D = – ε · l ·C; б) D = – ε · C; в) D = ε · l · C; г) D = l ·C.
142. Оптическая плотность раствора с концентрацией 2,2·10–5 моль/л (молярный коэффициент поглощения 4200) равна 0,277. Измерения проводили в кюветах с толщиной светопоглощающего слоя:
а) 1 см; б) 3 см; в)2 см; г) 5 см
143. Оптическая плотность раствора с концентрацией 2,5·10–5 моль/л, если молярный коэффициент поглощения равен 7 000, а измерения проводили в кювете с толщиной светопоглощающего слоя 1 см равна:
а) 0,175; б) 0,345; в) 0,231; г) 0, 163
144. При введении катализатора в систему не изменяется:
а) константа химического равновесия обратимой реакции;
б) скорость реакции;
в) энергия активации реакции;
г) доля активных частиц в реакционной смеси.
145. Увеличение скорости реакции в случае положительного катализа объясняется:
а) увеличением энергии активации реакции;
б) уменьшением доли активных частиц;
в) уменьшением энергии активации реакции;
г) уменьшением средней кинетической энергии молекул реагирующих веществ
146. Изменение скорости реакции в случае ингибирования объясняется:
а) уменьшением энергии активации;
б) увеличением доли активных частиц;
в) увеличением энергии активации;
г) действием промоторов
147. Гомогенный катализ – это каталитические реакции:
а) идущие на поверхностях раздела фаз, образуемых катализатором и реагирующими веществами;
б) характеризующиеся ускорением процесса одним из продуктов реакции;
 2020-07-12
2020-07-12 422
422








