АВТВ = 
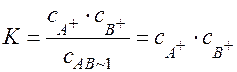 = ПР (Т = const)
= ПР (Т = const)
Произведение растворимости (ПР) – произведение молярных концентраций ионов:
а) малорастворимого;
b) сильного электролита;
с) в его насыщенном растворе;
d) при постоянной температуре.
Химия растворов
«Химия и жизнь» ч.2 «Химические новеллы» гл.12 «Океаны»
Растворы как источник жизни.
“Dead See”, дары моря в Азии
Из списка Нобелевских лауреатов
1901 г – Вант – Гофф – Первый нобелевский лауреат
химкинетика, осмос
1903 г – Аррениус – электролитическая теория диссоциации
1909 г – Оствальд – закон разведения
1925 г – Зигмонди – коллоидная химия
Раствор – гомогенная многокомпонентная система переменного состава
Простая бинарная система А-В
ЕАА~ЕВВ >> ЕАВ ® механическая смесь (вода + бензол)
ЕАА~ЕВВ << ЕАВ ® химсоединение (K + 2Na®KNa2)
ЕАА~ЕВВ~ЕАВ ® раствор (вода + спирт)
Растворы – газообразные
жидкие (в воде, неводные, расплавы)
твердые (Au + Ag, минералы)
Самопроизвольность образования растворов
DG<0
DHp-TDS < 0 ® TDS > DHp
DSp > DHp/T>0
увеличение беспорядка
Газовые смеси – идеальные растворы (ЕАА=ЕВВ=ЕАВ)
mi=mi0 + RTlnPi (7.1)
Жидкие растворы: растворитель + растворенное вещество (условность)

mi(г)=mi(ж) условие равновесия (7.2)
По определению, для пар. фазы
mi(г)=mi0(г) + RtlnРН2О (7.1)
для жидкой фазы – раствора
mi(ж)=mi0(ж) + Rtlnai = mi0(ж) + RTln(1-Nj) (7.3)
Равновесие «пар – чистая вода» из (7.1) – (7.3)
mi0(г) + RtlnР0Н2О=mi0(ж) (7.4)
Равновесие «пар – раствор»
mi0(г) + RtlnРН2О = mi0(ж) + RTln(1-Nj) (7.5)
Из (7.5) – (7.4)
РН2О/Р0Н2О = 1-Nj

 (7.6)
(7.6)
Первый закон Рауля

m – моляльная концентрация
Е – эбулиоскопическая константа
К – криоскопическая константа

где в – масса растворенного вещества, В – масса растворителя
tзам, 0С tкип,0С K E
Н2О 0 100 1.86 0.52
СН3СООН 16.7 118.1 3.81 3.07
С6Н6 5.5 80.1 5.4 2.57
Осмос – самопроизвольный переход вещества через полу - проницаемую мембрану, разделяющую раствор и чистый растворитель.
Селективное проникновение частиц опред. сорта через мембрану (Плате)
 Медный купорос
Медный купорос
Прибор для осмоса
Осмотическое давление
Росм.*V = nRT (7.9)
|
(7.10)
осмос – клетки – мембраны
изотонический коэффициент 
электролитическая диссоциация
Кистяковский, Каблуков (книга)

 (7.6)
(7.6)
|
DTкип = Еm
Росм = CRT (7.10)
Физическая теория растворов
Поведение растворителя под действием растворенного вещества
Растворы кислот, солей, оснований
Изотонический коэффициент

Одинаковость значения i в уравнениях (7.6), (7.7), (7.10)
Зависимость i от концентрации раствора
Измерения электропроводности растворов – С. Аррениус
Гипотеза электролитической диссоциации.
Менделеев, И.А. Каблуков, Кистяковский (книга Полищука)
Кислоты и основания по Аррениусу – соединения, диссоциирующие с образованием ионов Н+ и ОН-, соответственно.
Эффективность растворителя – диэлектрическая проницаемость
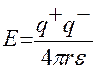
аммиак e=25
ацетон e=21.7
 бензол 2.3
бензол 2.3
вода
СН3СООН 6.2
Н2SO4 100
SO2 (ж) 15.4
Модель Бренстеда – Лоури (1923 г)
Кислота – донор протонов
 2020-06-29
2020-06-29 100
100









