
 Манхеттенский проект атомная бомба
Манхеттенский проект атомная бомба
проект Апполон человек на луне
результат деятельности крупных коллективов
«Гамлет» результат индивидуального
«Мона Лиза» творчества
Химическое творчество непредсказуемый поиск, архитектура химических фактов.
«Химия сама создает предмет своего исследования» - Бертло.
Откуда берет начало химия?
Первобытный человек – огонь
2Fe2O3 + 3C = 4Fe + 3CO2

 Е энергия Е энергия Е
Е энергия Е энергия Е
m вещество m вещество m
(NH4)2Cr2O7 → Cr2O3 +......
Fe2O3 + Al → Fe + Al2O3
H2O2 + K4[Fe(CN)6 ] + люминол
|
энергия межмолекулярного взаимодействия
энергия химической связи
энергия взаимодействия электронов и ядер
внутриядерная энергия
 |
кинетическая энергия системы как целого
энергия положения системы в пространстве
ракета в околоземном пространстве
|
∆U = U2 – U1 = Q – A (1.1)
A = p ∆V=p (V2 – V1) (1.2)
при V = const (изохорный процесс)
 ∆U = U2 – U1 = Qv (1.3)
∆U = U2 – U1 = Qv (1.3)
изохорный тепловой эффект
при р = const (изобарный процесс)
∆U = U2 – U1 = Qр – p (V2 – V1) (1.4)
или
Qр = (U2 – U1) +р(V2 – V1) = (U2 +рV2) – (U1 + рV1) (1.5)
|
(1.6)
Н – энтальпия, функция состояния
теплосодержание Н = f (p,V,U)
|
(1.7)
Из (1.3) и (1.4)
Qр – Qv = p·∆V = ∆(p·V) (1.8)
Согласно уравнению Клайперона – Менделеева
|
где R = 8.31 Дж/моль·К
n г – число молей газа
Из (1.8) и (1.9)
|
(1.10)
Для р-ций
H2 + Cl2 = 2HCl ∆ n г = 0, Qр = Qv
2H2 + O2 = 2H2O ∆ n г = –1 Qр – Qv = – RT = –2.5кДж/моль
калориметрия, т/краски, скамейка
 |
CH4 (г) + 2О2 = СО2 (г) + 2Н2О (ж) + 890кДж (1.11)
термохимическое уравнение, +Q и –Q
 |
 С + 2S = CS2 – 88кДж (1.12)
С + 2S = CS2 – 88кДж (1.12)
·
С + 2S + 88кДж = CS2 (1.12׀)
 |
 H2 + ½O2 = H2O(г) + 246 кДж
H2 + ½O2 = H2O(г) + 246 кДж
 2H2 + O2 = 2H2O(г) + 492 кДж
2H2 + O2 = 2H2O(г) + 492 кДж
10-3 10 103 1010кДж


 ׀ ׀ ׀ ׀
׀ ׀ ׀ ׀
жид. He хим. реакция космич. излучение
1 т С ≈ 1 г Ra
 |
H2O(г) + С(тв) = СО(г) + Н2(г) (1.13)
∆Н = (Н 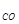 + Н
+ Н 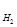 ) – (Н
) – (Н 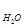 + Н
+ Н 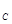 ) >0
) >0
 |
H2O(г) + С(т) = СО(г) + Н2(г) – 136 кДж
H2O(г) + С(т) = СО(г) + Н2(г) ∆Н = 136 кДж
изменение в системе (теплоподвод)
изменение в окружающей среде (отбор тепла)
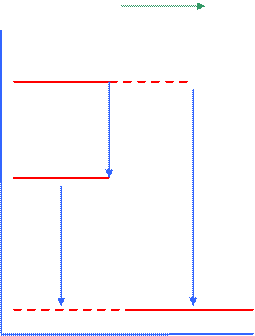 Салм Сграф ∆Нпр
Салм Сграф ∆Нпр
| Салм + О2 ∆Нпр Сгр. + О2 ∆Н2 Н ∆Н1 Энтальпий. диаграмма | Сгр. + О2=СО2 ∆Н1 = – 393,5 Сал. + О2=СО2 ∆Н2 = – 395,3 кДж/моль ∆Нпр= ∆Н2–∆Н1= –1.8кДж/моль | (1.14) (1.15) (1.16) |
Энтальпия (теплота) образования
станд. условия
∆Нообр,298 или ∆Но f . 298 1 атм. = 101325Па
25оС = 298.15К
Fe2O3 + 3CO = 2Fe + 3CO2 (1.17)
∆Но(1.17) = 3∆Но 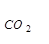 - ∆Но
- ∆Но 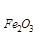 – 3∆Но
– 3∆Но 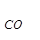
Из термических таблиц
∆Но 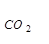 = – 393.5 кДж/моль, ∆Но
= – 393.5 кДж/моль, ∆Но 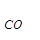 = – 110.5 кДж/моль
= – 110.5 кДж/моль
∆Но 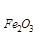 = – 820 кДж/моль
= – 820 кДж/моль
∆Но(1.17) = 3 (– 393.5) – (– 820) – (– 110,5) = – 29 кДж/моль
Тепловой эффект растворения ∆Нораств.
КОН(кр) = К+(р) + ОН-(р) (1.19)
∆Ηоf,298 – 425.8 – 251.2 – 230.2
∆Ηораст. = [(-251.2) +(-230.2)] - (-425.8) = – 55.6 кДж/моль
 |
теплота (энтальпия) фаз. перехода
SO3(ж) = SO3(г) (1.20)
∆Ηоf,298 – 439.0 – 396.1
∆Ηоисп = (–396.1) – (– 439.0) = 42.9 кДж/моль
 |
энергия ионизации атомов
Н(г) = Н+(г) + е- (1.21)
∆Ηоf,298 218,0 1536.2
∆Ηион = Jион = 1536.2 – 218,0 = 1318.2 кДж/моль
 |
Cl (г) + е- = Cl- (г) (1.22)
∆Η 121.3 –233.6
∆Ηэл.ср = (–233.6) – 121.3 = –354.9 кДж/моль
Задача на дом
 Сa3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO + Pбел (1.23)
Сa3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO + Pбел (1.23)
Вычислите теплоту, необходимую для плавления 1т Al, изначально находящегося при 25оС
 |
 Закон Лавуазье – Лапласа
Закон Лавуазье – Лапласа
∆Ηпр = – ∆Ηобр (Cl2O, ClO2, Cl2O7)
 Закон Гесса
Закон Гесса
|

|


 ∆Η2
∆Η2
∆Η1
|
|
|

 По определению, для вещества
По определению, для вещества
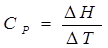 (1.25)
(1.25)
∆Η = СP · ∆Τ (1.26)
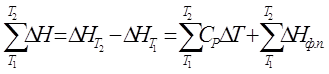 (1.27)
(1.27)
 |


 CP
CP
 |


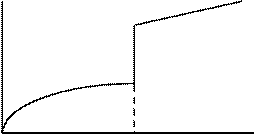
 |
 T1 Tф.п. T2 Т
T1 Tф.п. T2 Т
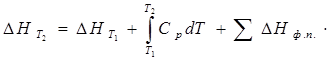 (1.28)
(1.28)
Для реакции (ур. Кирхгофа)

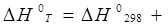
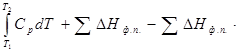 (1.29)
(1.29)
реаг прод
Ср = а + вТ + сТ2 + dT-2 (1.30)
∆Cp = ∆a + ∆вТ + ∆сТ2 + ∆dT-2 (1.31)
для твердых вещ. С = О, газов d =O
Энергия хим. связи EHCl =?
(EHCl = – ∆ НН – Cl)
∆Hf,HCl = –92,8
(∆Hдисс)Н2 = 435.0; (∆Hдис)Сl2 = 242,6 кДж/моль
½ Cl2(г) = Cl(г) ½(∆Hдисс)Сl2
½ Н2(г) = Н(г) ½(∆Hдисс)Н2
 Н(г) + Cl(г) = HCl(г) ∆НН – Cl
Н(г) + Cl(г) = HCl(г) ∆НН – Cl
½ Н2(г) + ½ Cl2(г) = HCl(г) ∆Ноf,НCl
½∆Hдис,Сl2 + ½∆Hдисс,Н2 = ∆НН – Cl = ∆Hof,HCl
∆НН – Cl = –92,8 –+ ½(435.0 + 242,6) = –431.6 кДж/моль;
|
Энтальпия (теплота) гидратации ∆Ηгидр
теплота перехода 1 моль ионов из вакуума в водн. р-р
∆Ηраств = ∆Ηреш + ∆Ηгидр (1.33)
 реш р-р >0 <0
реш р-р >0 <0

 реш ионы ионы р-р
реш ионы ионы р-р
∆Ηраств, КОН <0, т.к. ∆Ηреш<(∆Ηогидр,К + ∆Ηогидр,ОН)
экзо
∆Ηраств, КNO3 >0 т.к. ∆Ηреш>(∆Ηогидр,К + ∆Ηогидр, NO3)
Эндо

 из (1.33) ∆Ηгидр = ∆Ηраств – ∆Ηреш (1.34)
из (1.33) ∆Ηгидр = ∆Ηраств – ∆Ηреш (1.34)
∆Ηгидр, ан + ∆Ηгидр. кат
Генерация, хранение, транспорт энергии


 ТЭЦ, ЭС, АС, генер. схема экоэнергетики
ТЭЦ, ЭС, АС, генер. схема экоэнергетики
альтернативы?
водород, энергетика
Генерация Н2 из Н2О электролиз
 радиолиз
радиолиз
т/хим. циклы
М + Н2О = МО + Н2, у М ср-во к О выше, чем у Н
 2МО = 2М + О2, МО легко диссоц.
2МО = 2М + О2, МО легко диссоц.
730
2CuBr2 + 4 2Cu(OH)2 + 4 HBr

100
4HBr + Cu2O 2CuBr2 + H2O +
100
2CuBr2 + 2Cu(OH)2 2CuO + 2CuBr2 + 2H2O
1000
 2CuO Cu2O +
2CuO Cu2O +
2H2O = H2 + ½O2
FeCl3 · 6H2O Тпл = 310 К ∆Η = 336 кДж/моль
LiF + LiOH Тпл = 703 К ∆Η = 734 кДж/моль
2 лекция
Направление процессов в физ - хим. системах
I начало терм-ки ∆U = Q – A
Закон сохранения энергии – Лавуазье
«вечный двигатель» A = Q – ∆U
неравноценность источников энергии
«Жизнь» системы – процессы на макро- и микроуровне
Обратимые и необратимые процессы
плав
S ↔ L ∆Η =
зат-в
раств
S ↔ L ∆Η =
крист
S1 ↔ S2 (Tc = 760 и 362оС для Fe и Ni)
→
N2O4 ↔ 2NO2 ∆Η > O
→
2H2O ↔ 2H2 + O2 ∆Η > O
(термохимические циклы)
самопроизв. процессы
|
 если Т2 > Т1
если Т2 > Т1
чистые в-ва → загрязн. в-ва
«Candella»
СuSO4·5H2O → раствор
 Принцип Бертло
Принцип Бертло
 А + В → С + D, если ∆Η < O
А + В → С + D, если ∆Η < O
А + В → АВ
(самопроизвольные экзотерм. процессы)

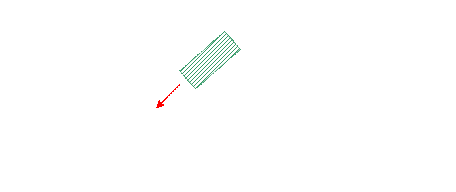
 Мех. система – стремление к изменению потенц. энергии и
Мех. система – стремление к изменению потенц. энергии и
рассеивание энергии в виде тепла (трение)
 Хим. система – уменьшение внутренней энергии (энтальпии) и увеличение беспорядка
Хим. система – уменьшение внутренней энергии (энтальпии) и увеличение беспорядка
 |

|
 |  | ||||
 | |||||

|

|
(Σ5)
Если 5 частиц, то Р^ = (1/2)5 = 1/32
| о о о о о о о о о о о о о о о о о о о о о о о о He о о о о о о о о о о о о о о о о о о о о о о о о | о о о о о о о о о о о о о о о о о о о о о о о о Ne о о о о о о о о о о о о о о о о о о о о о о о о | 
| о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о |
cост – е I cост – е II
(ст.бесп.-ка)2 > (ст.беспорядка),
(вер-ность)2 > (вер-ность)1
Самопр-сть перехода к более вероятн. состоянию (беспорядок)
(1/2) 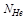 · (1/2)
· (1/2) 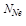 ·
· 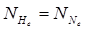 ~ 1023
~ 1023
Число микросостояний, через которые реализуется данное макросостояние, называется терм. вероятностью для сложной системы из 3 простых
W = W1·W2·W3
lnW = lnW1 + lnW2 + lnW3
Две тенденции
уменьшение энергии (∆Η < О)
увеличение беспорядка
(переход к более вероятн. состоянию)
Энтропия Дж/K·моль
|
Клаузиус, 1854
Энтропия – мера беспорядка
(логарифм. выражение вероятности состояния)
самопроизвольные изоэнергетические процессы с ∆S > О
и невозможны ____________ “____________ с ∆S < О
S растет при испарении, растворении, плавлении, увеличении Т, V,
уменьшении Р
Станд. энтропия Sо298 – 25оС ≡ 298К
101325Па
для H2Oкрист Sо298 = 39.33 Дж/K·моль
H2Oжид Sо298 = 70.08 Дж/K·моль = 70.08 э.е.
э.е. = Дж/K·моль
H2Oпар Sо298 = 188.72 Дж/K·моль
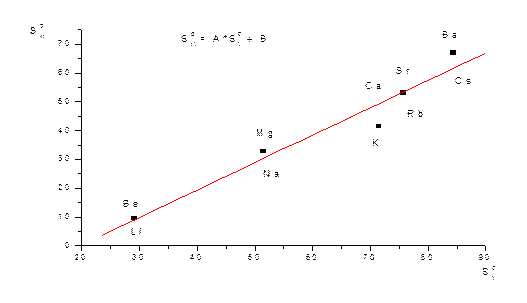
Sаморф > Sкр SSiO2, ст = 46.9; SSiO2, ст = 42.7
А + В = АВ ∆Sf, 298 = SоАВ - (SоА + SоВ)
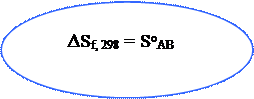 |
∆Η (Дж/моль), ∆S Дж/K·моль
∆Η Т·∆S
∆Η/Т ∆S
|
(3.2)
равн. состояние, II начало терм-ди
 ∆Ηпл = Тпл · ∆Sпл, ∆Sпл =
∆Ηпл = Тпл · ∆Sпл, ∆Sпл = 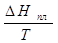
|
1) ∆Η < O и ∆S > O, самое благопр
2) ∆Η > O и ∆S < O, самое неблагопр
∆Η > Т∆S невозм.
 3) ∆Η > O, ∆S > O ∆Η < Т∆S возм
3) ∆Η > O, ∆S > O ∆Η < Т∆S возм
 ∆Η < Т∆S невозм
∆Η < Т∆S невозм
 4) ∆Η < O, ∆S < O ∆Η > Т∆S возм
4) ∆Η < O, ∆S < O ∆Η > Т∆S возм

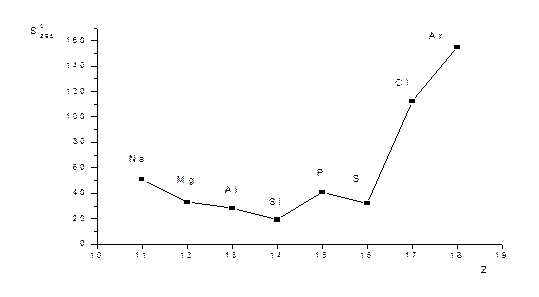
S0298(граф) = 5,74, S0298(алм) = 2,39
S0298(O3) = 238.8; S0298(O2) = 205; S0298(O) = 160.9
S0298(F2) < S0298(Cl2)< S0298(Br2) < S0298(J2)
1/2C(гр) + 1/2СО2 (г) = СО(г) S ® растет
1/2*5,74 1/2*213,68 197,54
DS0298 = 197.54-1/2(5.74+213.68) = 87.8 Дж/К×моль
3/2H2 + 1/2N2 = NH3(г) DS0298 уменьшается
DS < 0, т.к. DV < 0
Al(кр) + Sb(кр) = AlSb(кр) DS0298 = -5 э.е.
Ств + О2(г) = СО2(г) DS0298 = 2,9 Дж/К×моль
3 лекция
 Направление процессов в физико - хим. системах (продолжение)
Направление процессов в физико - хим. системах (продолжение)
|
|
Энтропия
W – вероятность макросостояния
S – мера беспорядка
Стремление системы к уменьшению Н (∆H < 0) и
к увеличению S (∆S > 0)
 самопроизв. процессы с ∆H < 0
самопроизв. процессы с ∆H < 0
2Fe + Al2O3 → 2Al + Fe2O3
плазма → атомы → молекулы →
ассоциаты → кластеры → кристаллы
 самопроизв. процессы с ∆S > 0
самопроизв. процессы с ∆S > 0
растворение солей (KМnO4 + H2O)
образование дефектов в кристаллах
самозагрязнение ОЧ в-в
 процессы вопреки условию
процессы вопреки условию
∆H < 0 (N2O4 → 2NO, ∆H > 0)
∆S > 0 (крист-ция солей из пересыщ. р-ров)
конкуренция двух тенденций –
стремление к уменьшению Н
и к увеличению S
∆Η (Дж/моль), ∆S (Дж/К∙моль)
 ∆Η Т∆S
∆Η Т∆S
|
равнов. состояние системы
 |
1) ∆Η < O, ∆S > O, самое благопр.
2) ∆Η > O, ∆S < O, самое неблагопр.
 ∆Η > Т∆S - невозм.
∆Η > Т∆S - невозм.
 3) ∆Η > O, ∆S > O ∆Η < Т∆S - возмож.
3) ∆Η > O, ∆S > O ∆Η < Т∆S - возмож.
 ׀ ∆Η ׀ < Т ׀∆S׀ - невозм.
׀ ∆Η ׀ < Т ׀∆S׀ - невозм.
 4) ∆Η < 0, ∆S < 0 ׀∆Η׀ > Т ׀∆S ׀ - возмож.
4) ∆Η < 0, ∆S < 0 ׀∆Η׀ > Т ׀∆S ׀ - возмож.
∆Ηпл = Тпл · ∆Sпл, откуда
∆Sпл = ∆Ηпл / Тпл
2Н2 + О2 ↔ 2Н2О
∆Η < 0, ∆S < 0
СН4 + 2О2 → СО2 + 2Н2О
СО + Н2О ↔ СО2 + Н2
А + В = АВ ∆Sоf,298 = SоАВ – (SоА + SоВ)
 |
расчет S из ср = f(Т)
Теплоемкость ср = 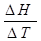 (3.1)
(3.1)
ср = a + bТ + сТ2 - dТ-2 (3.2)
∆S = 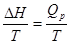 (3.3)
(3.3)
При нагреве от Т до Т + ∆Τ, р = const из (3.1) следует
Qp = Cp·∆Τ (3.4)
(3.4) подставляем в (3.3)
∆S = 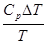
Измеряем Ср от ОоК до Т, 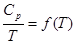
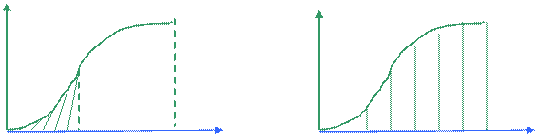 |
Ср 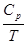
 Т1 Т2 Т 0 Т Т
Т1 Т2 Т 0 Т Т
S(T) – S(O) = 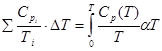 (3.5)
(3.5)
∆Sисп = 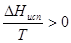 ∆Sпл =
∆Sпл = 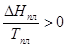
∆U=Q A (3.6)
Если
А = Амех + Ахим (3.7)
то
∆U=Q – Амех – Ахим (3.8)
При р = const
∆U = (Qр – р·∆V – Ахим)р (3.9)
Так как Qр = ∆Η = Т·∆S (3.10)
то
∆U = (Т·∆S – р·∆V – Ахим)р (3.11)
или
– Ахим = (∆U + р·∆V – Т·∆S)р (3.12)
При Т = const
|

 – Ахим = ∆(U + рV – ТS)р,т (3.13)
– Ахим = ∆(U + рV – ТS)р,т (3.13)
 |
энергия Гиббса
 |
изоб – изотерм. или химич. пот-л
Z ≡ G ≡ μ = U + рV – ТS = Η – ТS (3.14)
Из (3.13) и (3.14)
– Ахим = ∆Gр,т ≡μ (3.15)
где ∆G = ∆Η – Т∙∆S (3.16)
∆G как критерий самопроизв. процесса
∆G < 0 – р-ция идет самопроизв.
∆G > 0 – р-ция невозможна
∆G = 0 – равновесие
Чем больше ∆G, тем дальше система от состояния р-сия

| ∆Η | |
 ∆U ∆U
|   р·∆V р·∆V
| |
 Т·∆S Т·∆S
| 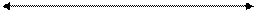 
| ∆G (≡∆μ) |
MgO + C = Mg + CO (k)
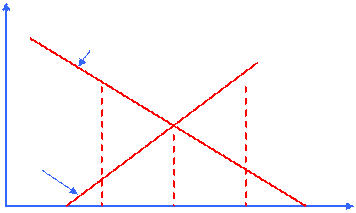 |
-5000
∆G0(C→CO)
∆G0f
-1000 ∆G0(Mg→MgO)
T1 Tp T2 T
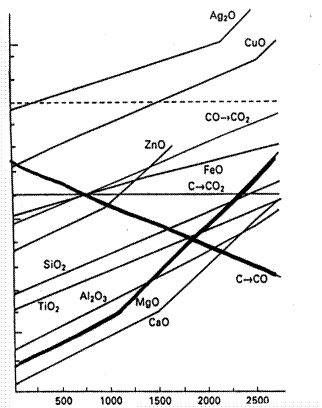
+250
 0
0
 |
-500
 |
-1000
|
Mg + 1/2O2 = MgO
C + 1/2O2 → CO
борьба за кислород при Т = Тр – равные coп-ки
при Т2 > Тр побеждает С – обр-ся Mg по р. (K)
при Т1 < Тр побеждает Mg – обр-ся С по р-ции обр. р-ции
4 лекция
Химическое равновесие

H, S, G ≡ Z
H – энтальпия (т – сод-ние)
H = U +pV
S – энтропия (степень беспорядка)
S = RlnW
(размерность)
∆Η >< ∆S·Т
(энтальп. и энтроп. вклады как f(T)
G ≡ μ = U + pV – TS = H – TS
 - Aхим = ∆μ
- Aхим = ∆μ
для реакции
аА + вВ = сС + dD (4.1)
 |
∆μ(4.1) = μкон - μнач = сμс + dμd – aμA – вμВ (4.2)
 |
По определению
μi = μоi + RTlnai (4.3)
Подставляя μi для i = A, B, C, D
из (4.3) в (4.2)
получаем
μ(4.1) = μо(4.1) + RT ln 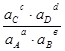 (4.4)
(4.4)
В состоянии р-сия
∆G ≡ ∆μ = 0 (4.5)
следовательно
∆Gо = μо(4.1) = - RTln 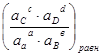 (4.6)
(4.6)
В скобках – константа равновесия реакции (4.1)
Кр = 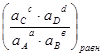 = f(T) (4.7)
= f(T) (4.7)
Из (4.4) и (4.6)
∆G ≡ ∆μ = RTln 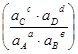 = – RTln
= – RTln 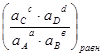 (4.8)
(4.8)
∆Gо = ∆μо = – RTlnКр (4.9)
Из (4.9) следует
–RTlnКр = ∆Но – Т∆So
lnКр = 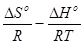 (4.10)
(4.10)
 lnКр y = a – вx
lnКр y = a – вx
 |





|
 tgα=
tgα=
 | ||||
| ||||

 Справочник термод. содержит ∆Ηo, So
Справочник термод. содержит ∆Ηo, So

Кравн
Из Кравн = f(T)
Получают ∆Ηo и ∆So
Na (чист.) аNa = 1
Na + ½Сl2 = NaCl
Из (4.9)
∆Gf,298o = –RTln 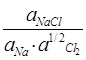
∆Gf,298o = – 385кДж/моль

RTln 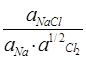 = 385кДж/моль
= 385кДж/моль
lg aNa = 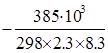 = – 100
= – 100
aNa = 10-100
Cu2+р-р + Znтв = Cuтв + Zn2+р-р (4.11)
 Cu2+р-р + 2 е ' = CuТВ
Cu2+р-р + 2 е ' = CuТВ
Znтв = Zn2+р-р + 2 е ' (4.12)
Как сравнивать ок/восст способность?
М+р-р + 1/2Н2 + Н2О ↔ Мтв + Н3О+ (4.13)
в более общем виде
Xn+р-р + 1/2Н2 + Н2О ↔ X (n-1)+ + Н3О+ (4.14)
Если ∆Go (4.13) < 0, то
Кр(4.13) > 1
и Н2 в паре ½Н2/Н3О+
восстанавливает
М +р-р до Мтв
10-50 < Кр(4.13) < 1020
Окисл. – восст. Ряд
по величине ∆Go
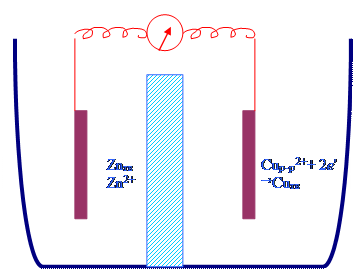
Znтв + Сuр-р2+ =
Znр-р2+ + Сuтв
разделение ок. и восст. процессов
в простр-ве в
ХИТ – гальв. ячейка – эх элемент
При превращении 1 моль в-ва совершается работа
Аэх = nEF (4.15)
F – число Фарадея, 96500 кл/моль
Т.к. – Ах (≡Аэх) = ∆G (4.16)
то
∆G = – nFE (4.17)
∆G < 0, когда Е > 0 (самопроизв. процесс)
 |
Т.к. μi = μоi + RTlnai, то
для оценки ∆Gо надо измерять
Е = Ео при 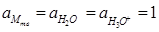
|
где Eо – станд. электрод.пот-л, т.е.
пот-л ХИТ, в котором
1) М+ + е ' (эл-д) ↔ Мтв (4.19)
при 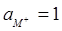
2) ½Н2 + Н2О(х) ↔ Н3О+ + е ' (эл-д)
при 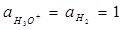 (4.20)
(4.20)
 |
Ео → Кравн (4.13)
Если Ео > 0, то ∆Gо < 0 и
Мтв менее актив. восст-ль, чем Н2 и наоборот
(табл. пот-лов)
Стандартные электродные потенциалы Е298о (В) в водных растворах
| Е298о, В | |
| Li+ + e -→ Li | -3,01 |
| Rb+ + e -→ Rb | -2,98 |
| K+ + e -→ K | -2,92 |
| Na+ + e -→ Na | -2,71 |
| SO42- + H2O + e - → SO32- + 2OH- | -0,93 |
| 2H2O +2 e - → H2 + 2OH- | -0,83 |
| Fe2+ +2 e - → Fe | -0,44 |
| Pb + 2 e - → Pb | -0,13 |
 H+ + e - → ½ H2 H+ + e - → ½ H2
|  0,00 0,00
|
| Cu2+ + 2 e -→ Cu | 0,34 |
| O2 + 4 e -→ 4OH- | 0,40 |
| I2(K) + 2 e -→ 2I- | 0,54 |
| MnO4- + e -→ MnO42- | 0,54 |
| MnO4- + 2H2O + 3 e -→ MnO2 + 4OH- | 0,59 |
| MnO4- + 8H + 5 e -→ Mn2- + 4H2O | 1,51 |
| Au+ + e -→ Au | 1,70 |
| F2 + 2H+ +2 e -→ 2HF(р) | 3,06 |
Для реакции (4.13)
∆G = ∆Go + RTln 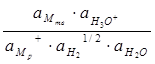 (4.21)
(4.21)
Учитывая, что
∆G = – nFE, ∆Go = – nFEо
получаем
Е = Ео + RT/F·ln 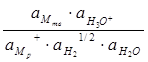 (4.22)
(4.22)
Если 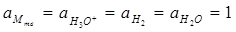
то
|
В более общем случае
|
Уравнение Нернста
При Т = 300К
|
Е =f (pH)
MnO4- + 8H3O+ + 5 e ' = Mn2+ + 12H2O E1o = 1.51B
MnO4- + 4H3O+ + 3 e ' = MnO2 + 6H2O E2o = 1.70B
MnO2 + 4H3O+ + 2 e ' = Mn2+ + 6H2O E3o = 1.23B
Е = Ео + 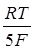 ln
ln 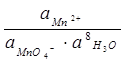
Если  , то
, то
Е1 = Е1о – 0.0947 рН
Е2 = Е2о – 0.0789 рН
Е3 =..............
Зломанов Владимир Павлович
Химфак МГУ
Россия
 |
Лекция 7. Растворы I.
§ 1. Типы взаимодействия твердых веществ А + В.
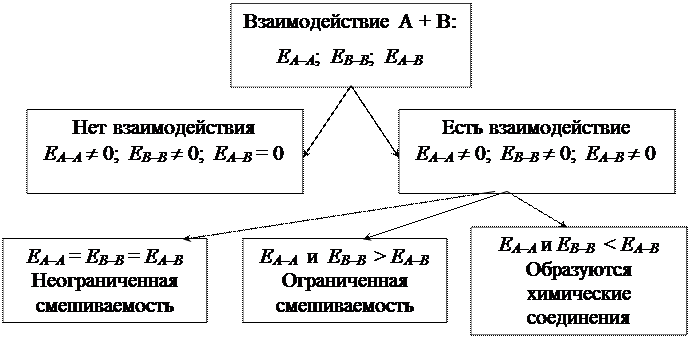 | |||
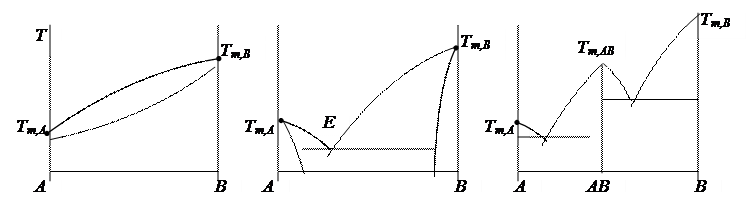 | |||
§ 2. Основные понятия учения о растворах.
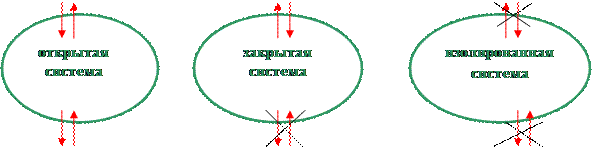
2.1. Фаза – гомогенная часть гетерогенной системы.
2.2. Система.
2.3. В термодинамике состояние системы описывается набором координат или параметров: P, T, V, G, H, S и т.д.
2.4. Они связаны между собой уравнениями, например:
(1) 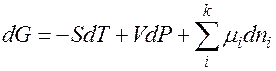
G = G (T, P, ni)
G – энергия Гиббса
S – энтропия
V – объем
Р – давление
ni – число молей i -ого компонента
mi – химический потенциал i -ого компонента.
2.5. Фаза – совокупность частей системы, которая описывается одним и тем же уравнение состояния (1).
2.6. Раствор – фаза переменного состава.
|
|
 2020-06-29
2020-06-29 74
74

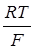 ln
ln 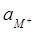
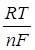 ln
ln 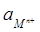
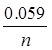 ln
ln 






