Тема 26. Расчеты массовой доли химического соединения в смеси
Основные формулы и соотношения
Массовая доля вещества в растворе
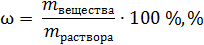 (1)
(1)
где: w – массовая доля вещества в %;
m вещества – масса вещества, г;
m раствора – масса раствора, г, в которой содержится m вещества.
Если не умножать на 100 %, то w – массовая доля вещества в долях единицы:
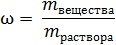 (2)
(2)
Пример: найти массу нитрата серебра, которая содержится в 255 г 25 %-ного раствора.
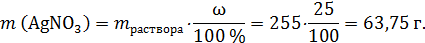
В задачах очень часто встречается не масса раствора, а плотность и объем раствора, тогда:
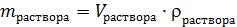
(3)
где: V раствора – объем раствора, мл;
rраствора – плотность раствора, г/мл.
Пример: найти массу хлороводорода, которая содержится в 250 мл хлороводородной кислоты (плотностью 1,1 г/мл) с массовой долей 20 %.
Хлороводородная кислота – раствор хлороводорода в воде. Масса раствора:
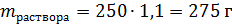
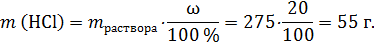
Здесь отметим, что не следует массу вещества рассчитывать сразу по общей формуле:
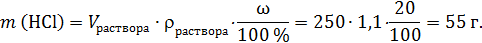
это
во-первых: не наглядно;
во-вторых: трудно проверять эксперту;
в-третьих: в 90 % случаев в ходе решения задачи понадобится масса раствора.
Понятие «растворимость»
Растворимость – это способность вещества растворяться в воде или другом растворителе. Растворимость зависит как от природы вещества и растворителя, так и от температуры. Например, при температуре 10°С растворимость KNO3 составляет 20 г соли на 100 г воды, а при температуре 50°С – уже 85 г соли на 100 г воды. Поэтому, говоря о растворимости, всегда приводят значение температуры.
Обычно (в том числе и в заданиях ЕГЭ) растворимость вещества – максимальное количество грамм этого вещества, которое при указанной температуре растворяется в 100 г растворителя (обычно воды). Больше вещества при данной температуре раствориться не может, т.е. растворимость показывает максимальную концентрацию вещества в растворе при данной температуре – концентрацию насыщенного раствора.
Рассмотрим на примере KNO3: возьмем 100 г воды и добавим к ней 100 г этой соли. При 10°С растворится только 20 г соли, 80 г не растворится, останется в виде кристаллов, масса раствора составит 20 + 100 = 120 г, а массовая доля соли в растворе составит
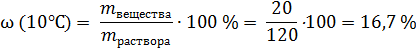
Это – массовая доля (в процентах) соли в насыщенном растворе при 10°С.
Если нагреть этот раствор с осадком до 50°С (растворимость при 50°С составляет 85 г соли на 100 г воды), то еще 65 г кристаллов соли растворится:
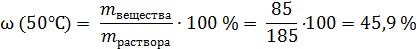
Это – массовая доля (в процентах) соли в насыщенном растворе при 50°С.
Если теперь охладить раствор до 10°С, из раствора выделится 65 г соли.
Задачи с термином «растворимость» появились в ЕГЭ в 2019 году, приведем примеры:
Пример: при комнатной температуре приготовили 216 г насыщенного раствора хлорида натрия, растворимость которого составляет 36 г на 100 г воды. Какая масса соли содержится в приготовленном растворе?
При решении задач 34 и 35, в которых приводится текст решения, рекомендую использовать простой ход решения – не подставлять одни формулы в другие, решать последовательно и т.п.
Рассчитаем массовую долю соли в насыщенном растворе:

Масса соли в 216 г раствора составит:

Пример: растворимость безводного сульфата меди при некоторой температуре составляет 72 г на 100 г воды. Какую массу медного купороса (CuSO4×5H2O) нужно добавить к 100 мл воды для получения насыщенного раствора.
Довольно часто в ЕГЭ в расчетных задачах приводят кристаллогидраты. Надо понимать, что при введении кристаллогидрата, одновременно с солью вводится и вода.
Сначала рассчитаем массовую долю сульфата меди в насыщенном растворе:
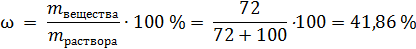
Рассчитаем молярные массы:
M(CuSO4) = 64 + 32 + 4×16 = 160 г/моль
M(CuSO4×5H2O) = 160 + 5×18 = 250 г/моль
Рассчитаем массовую долю безводного сульфата в купоросе:
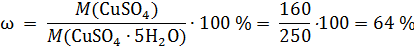
т.е. добавляя 100 г купороса к воде мы добавляем 64 г безводной соли и, одновременно, 36 г воды, а добавляя x г купороса – 0,64× x безводной соли.
Рассчитаем массу купороса x, которую нужно добавить к 100 мл (100 г) воды, для получения насыщенного раствора, т.е. раствора с w = 41,86 %. Составим уравнение:
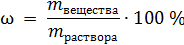
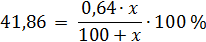
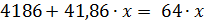
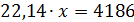
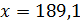
Ответ: к 100 мл воды нужно добавить 189,1 г CuSO4×5H2O.
Пример: 300 г горячего 40%-го раствора соли охладили до комнатной температуры. Насыщенный при комнатной температуре раствор содержит 25 % соли. Найти массу безводной соли, которая выпала в осадок (выкристаллизовалась) при охлаждении.
В исходном горячем растворе содержалось:
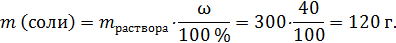
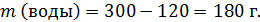
В охлажденном растворе 180 г воды – это 75 % от массы раствора, т.е. масса охлажденного раствора:
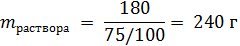
В осадок выпадет 300 – 240 = 60 г соли.
 2020-06-29
2020-06-29 94
94







