Тема 27. Установление молекулярной и структурной формулы вещества
Определение формулы вещества по массовым долям
При решении подобных задач нужно помнить, что в условии заданы массовые проценты, а составить формулу можно зная мольные соотношения между атомами. Например, 1 моль этилена С2Н4 содержит 2 моль атомов углерода и 4 моль атомов водорода. Мольное соотношение между атомами n (С): n (Н) = 1: 2. Массовые доли (в процентах) можно вычислить исходя из молярных масс по формуле:

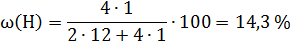
где 12 и 1 – молярные массы углерода и водорода соответственно.
Обратим внимание, что то же мольное и массовое соотношение С: Н и у других соединений, с общей формулой C n H2 n, например, у бутена С4Н8:


Поэтому по массовым процентам можно установить мольное соотношение и простейшую формулу, а для определения истинной молекулярной формулы необходимы дополнительные условия и указания. Рассмотрим на примерах.
Пример 1. Некоторое органическое вещество содержит 82,76 % углерода и 17,24 % водорода. Плотность паров этого вещества по водороду равна 29. Известно, что в веществе есть третичный атом углерода. Установите молекулярную и структурную формулу.
Массовое соотношение:
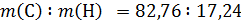
Для перехода к мольному соотношению разделим массовые проценты на соответствующие молярные массы:

Атомы в молекуле относятся между собой как небольшие целые числа, для перехода к целым числам разделим на наименьшее – 6,90:

приведем к целым числам

Или в виде формулы С2Н5. Это – простейшая формула заданного органического вещества, понятно, что такое же мольное соотношение С: Н будет у всех углеводородов с формулой С2 n Н5 n. Для установления истинной формулы приведена плотность паров по водороду.
Напомним, что плотность паров по указанному газу показывает, во сколько раз один газ «тяжелее» другого, т.е. соотношение их молекулярных масс:

Найдем молекулярную массу искомого вещества:

Из углеводородов с формулой С2 n Н5 n молярную массу 58 имеет вещество с формулой С4Н10. Это молекулярная формула искомого вещества. Структурную формулу установим из условия, что в веществе есть третичный атом углерода:

Пример 2. (https://scienceforyou.ru) Некоторое органическое вещество А содержит по массе 13,58 % азота, 46,59 % углерода и 31,03 % кислорода и образуется при взаимодействии вещества Б с этанолом в молярном отношении 1:1. Известно, что вещество Б имеет природное происхождение. Составьте структурную формулу вещества А.
Во-первых, обратим внимание, что сумма процентов не равна 100, и не указана массовая доля водорода. Рассчитаем ее по разности:

Водород может быть не указан в условии, так как он содержится в подавляющем большинстве органических соединений.
Массовое соотношение:

Для перехода к мольному соотношению разделим массовые проценты на соответствующие молярные массы:

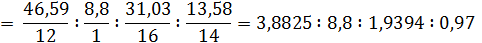
Атомы в молекуле относятся между собой как небольшие целые числа, для перехода к целым числам разделим на наименьшее – 0,97:

Или в виде формулы С4Н9О2N1. Такую формулу может иметь нитросоединение, аминокислота и ее сложный эфир (напомним, что предельные одноосновные карбоновые кислоты изомерны сложным эфирам). С учетом условия – это сложный эфир этилового спирта и природной a-аминокислоты:
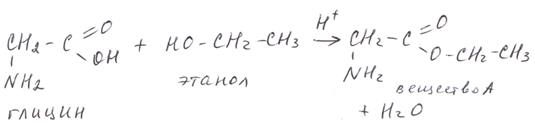
 2020-06-29
2020-06-29 144
144







