Напомним, что при полном сгорании углеводородов и кислородсодержащих органических веществ образуется углекислый газ и вода, например:
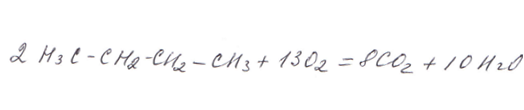
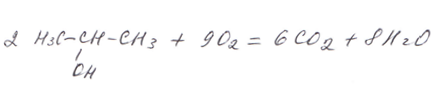
При горении азотсодержащих веществ выделяется газ азот, например:
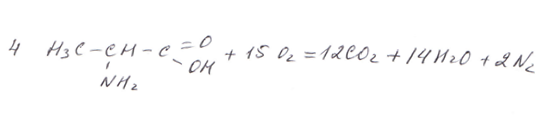
При горении галогенпроизводных – галогенводород, например:
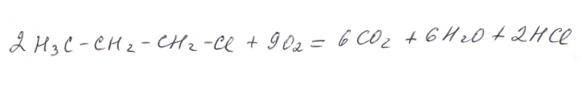
Число моль продуктов сгорания соответствует мольному соотношению компонентов в формуле органического вещества. Например, при сгорании 1 моль этилена образуется 2 моль углекислого газа и 2 моль воды:
С2Н4 + 3О2 = 2СО2 + 2Н2О
2 моль углекислого газа содержит 2 моль атомов углерода, 2 моль воды содержит 4 моль атомов водорода, т.е. 1 моль этилена содержит 2 моль углерода и 4 моль водорода.
Пример 3. При сжигании 6,6 г органического вещества было получено 6,72 л углекислого газа (н.у.) и 5,4 мл воды. Известно, что это вещество имеет неразветвленный углеродный скелет и может реагировать с карбонатом натрия. Установите молекулярную и структурную формулу вещества.
Рассчитаем количества вещества углекислого газа:
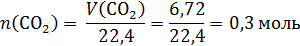
Рассчитаем количества вещества воды: объем воды дан в мл, из этого понятно, что это объем жидкой воды, т.е. таким способом задана масса воды, которая равна 5,4 г (в задачах ЕГЭ плотность воды по умолчанию равна 1 г/мл):
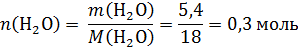
Определим количества углерода и водорода в исходном органическом соединении:
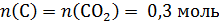
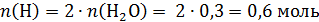
!Обратим внимание, что углекислый газ и вода образуются при горении и углеводородов, и кислородсодержащих органических веществ, нужно проверить, не содержало ли исходное вещество кислород. Для этого найдем массы углерода и водорода:
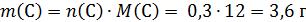
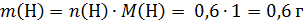
В сумме углерод и водород имеют массу 3,6+0,6=4,2 г, а масса органического вещества 6,6 г, значит, оно содержит кислород массой:
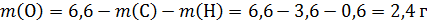
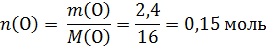
Обратим внимание – атомная масса элемента водорода 1, элемента кислорода 16, в расчете мольных соотношений в формуле используем именно эти массы!
Мольное соотношение компонентов в органическом веществе:
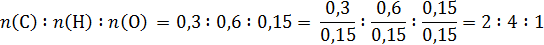
Простейшая формула С2Н4О. Вещество реагирует с карбонатом натрия – значит, вещество – карбоновая кислота. Общая формула предельных одноосновных карбоновых кислот С n H2 n O2. Таким образом, соотношение С: Н в простейшей формуле 2: 4 соответствует именно предельной одноосновной карбоновой кислоте. Удвоим простейшую формулу С2Н4О (содержание кислорода в кислоте = 2), получим искомую молекулярную формулу С4H8O2. В условии задачи указано, что вещество имеет неразветвленный углеродный скелет, значит структурная формула:
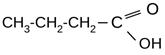
Пример 4. При сгорании 2,16 г органического вещества, плотность паров которого 2,41 г/л (н.у.), получили 7,04 г углекислого газа и 2,16 г воды. Известно, что вещество реагирует с аммиачным раствором оксида серебра, а также с бромной водой. Составьте молекулярную и структурную формулу вещества.
Определим простейшую формулу по продуктам сгорания:
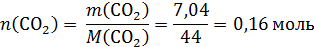
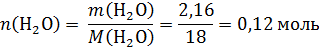
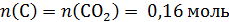
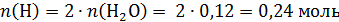
Проверим, содержит ли вещество кислород:
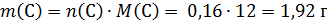
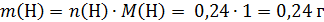
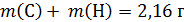
Вещество не содержит кислород.
Мольное соотношение компонентов в органическом веществе:
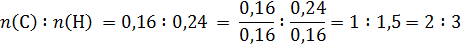
Простейшая формула С2Н3. Истинную, молекулярную формулу установим по плотности паров вещества. Известно, что 1 моль вещества при нормальных условиях занимает объем 22,4 л
1 моль – 22, 4 л
С другой стороны, масса 1 моль вещества – это молярная масса:
1 моль – М (в-ва)
Объединим: масса 22,4 л равна молярной массе:
22,4 л – 1 моль – М (в-ва)
Плотность паров вещества 2,41 г/л означает, что масса 1 л вещества 2,41 г. Составим пропорцию:
22,4 л – М (в-ва)
1 л – 2,41 г
Откуда
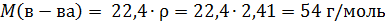
Из углеводородов с формулой С2 n Н3 n молярную массу 54 имеет вещество с формулой С4Н6. Это молекулярная формула искомого вещества. Судя по формуле, это или алкин или алкадиен. Но с аммиачным раствором оксида серебра реагируют алкины, причем с тройной связью между 1 и 2 атомом углерода, отсюда структурная формула:
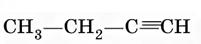
Пример 5. При сгорании органического вещества А получили 5,04 л углекислого газа, 3,36 л хлороводорода (все при н.у.) и 2,7 мл жидкой воды. Известно, что это вещество может быть получено при взаимодействии соответствующего углеводорода с избытком хлороводорода. Установите молекулярную и структурную формулу вещества А.
Определим простейшую формулу по продуктам сгорания:
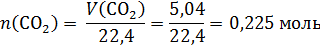
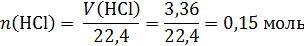
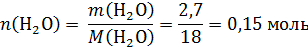
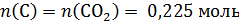
!Обратим внимание, водород из сгоревшего вещества перешел и в воду, и в хлороводород!:
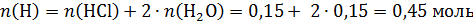
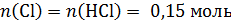
Вещество не содержит кислород, так как может быть получено из углеводорода и хлороводорода.
Мольное соотношение компонентов в органическом веществе:
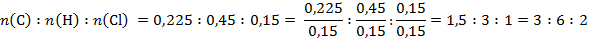
Простейшая формула С3Н6Cl2. Эта же формула является и истинной, молекулярной. Вещества С6Н12Cl4, С9Н18Cl6 и т.д. не могут существовать, как не могут существовать углеводороды состава С6Н16, С9Н24: у углерода не хватит связей для их образования.
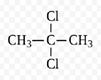
Структурную формулу вещества С3Н6Cl2 установим из условия, что оно может быть получено при взаимодействии соответствующего углеводорода с избытком хлороводорода. Так как в формуле 2 хлора, а хлороводород в избытке, то, очевидно, вещество было образовано из алкина С3Н4, с учетом правила Марковникова:
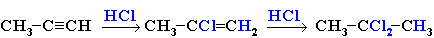
Структурная формула вещества
 2020-06-29
2020-06-29 114
114








