- Каталлитическая (Ферменты) – Сократительная (миозин, тубулин)
- Структурные (коллаген, эластин)
- Регуляторные (Кальмодулин) – Защитные (иммуноглобулины)
- Транспортные (Альгумин) – Резервные(все)
25)Физико-химические свойства белков
Для белков характерны следующие физико-химические свойства:
1. Растворимость. Она зависит от аминокислотного состава белка и природы растворителя. Водорастворимые белки называются альбуминами, к ним относятся белки крови и молока. К нерастворимым, или склеропротеинам, относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т. п.) и фиброин, который входит в состав шёлка и паутины
2. Ионизация. Заряд белковой молекулы обусловлен реакцией среды и соотношением ионогенных групп в белковой молекуле.
3. Гидратация. Молекула белка дифильна, в ней имеются гидрофильные и гидрофобные группы, причем гидрофильные в большинстве нативных белков находятся на поверхности, а гидрофобные внутри белковой молекулы.
4. Способность белков к денатурации. Под денатурацией белка понимают нарушение нативной конформации белковой молекулы, приводящее к уменьшению или полной потере ее растворимости, изменению других физико-химических свойств, утрате специфической биологической активности.
5. Ренатурация- это обратный переход молекулы биополимера, направление белка или нуклеиновой к-ты, из денатурированного (неактивного) состояния в нативное (биологически активное). Если при денатурации белка физико-химич. изменения связаны с переходом полипептидной цепи из плотно упакованного (упорядоченного) состояния в беспорядочное, то при Ренатурации проявляется способность белков к самоорганизации, путь который предопределён последовательностью аминокислот в полипептидной цепи
Факторы, определяющие стабильность белковых растворов:
● наличие зарядов в белковой молекуле. Одноименные заряды способствуют растворимости белка, т.к. препятствуют соединению молекул и выпадению в осадок.
● Наличие гидратной оболочки, препятствующей объединению белковых молекул.
Для осаждения белка, его необходимо лишить этих двух факторов устойчивости. Методом осаждения белка является высаливание - осаждение белка с помощью нейтральных солей. В полунасыщенном растворе (NH4)2-SO4 осаждаются глобулины, а в насыщенном - альбумины.
После удаления осаждающего фактора, белки переходят в растворённое состояние
26) Растворы ВМС. Лиофильные коллоидные растворы
К лиофильным коллоидным растворам относятся растворы поверхностно-активных веществ (ПАВ) и высокомолекулярных соединений (ВМС). Мицеллами лиофильных коллоидных растворов называются ассоциаты из молекул ПАВ и ВМС, возникающие самопроизвольно при концентрации, равной или большей критической концентрации мицеллообразования (ККМ), и образующие в растворе новую фазу.
Мицеллообразование, самопроизвольная ассоциация молекул ПАВ в растворе. В результате в системе ПАВ-растворитель возникают мицеллы-ассоциаты характерного строения, состоящие из десятков дифильных молекул, имеющих длинноцепочечные гидрофобные радикалы и полярные гидрофильные группы. В так называемых прямых мицеллах ядро образовано гидрофобными радикалами, а гидрофильные группы ориентированы наружу. Число молекул ПАВ, образующих мицеллу, называют числом агрегации;
При образовании коллоидных частиц молекулы ПАВ ориентируются так, чтобы поверхность мицеллы по полярности была близка дисперсионной среде. В полярной дисперсионной среде (вода) поверхность мицеллы образована полярными группами, а ядро - гидрофобными фрагментами молекул ПАВ
Высаливанием- называется разрушение лиофильных коллоидных растворов в результате практически полной десольватации мицелл, сопровождающееся выделением. Высаливающее действие на лиофильные коллоидные системы оказывают все ионы, независимо от их заряда.
Солюбилизация - самопроизвольный переход труднорастворимых низкомолекулярных соединений в водную фазу под действием коллоидных растворов Поверхностно-активные вещества.
27)Особенности растворов ВМС: набухание и растворение
Растворение высокомолекулярных соединений представляет собой сложный процесс, отличающийся от растворения низкомолекулярных веществ. Так, при растворении последних происходит взаимное смешение растворителя и растворяемого вещества, т.к. они имеют близкие по размерам и по скорости диффузии молекулы.
При растворении полимеров вначале происходит процесс их набухания, т.е. одностороннее проникновение небольших и подвижных молекул растворителя в полимер. Набухание сопровождается увеличением массы и размеров твердого образца полимера и является начальным этапом растворения высокомолекулярных веществ. Различают ограниченное и неограниченное набухание.
При ограниченном набухании объем и масса растворяемого образца полимера увеличивается до определенных пределов и дальнейший его контакт с растворителем не приводит к каким-либо изменениям. В результате ограниченного набухания полимер превращается в студень.
При неограниченном набухании отсутствует предел набухания. Со временем образец полимера поглощает все большее количество жидкости и в результате в конечном итоге происходит его постепенное растворение.
Для многих веществ набухание включает не только диффузию жидкости в полимер, но и сольватацию его молекул. Обычно при этом сольватируется не вся макромолекула, а отдельные ее участки.
У биополимеров, макромолекулы которых состоят из полярных и неполярных групп, сольватируются полярные группы, если растворитель полярен. В неполярном растворителе, соответственно, сольватируются неполярные участки макромолекул.
Обычно он хорошо набухает в жидкости, близкой к нему по химическому строению. Так, углеводородные полимеры типа каучуков набухают в неполярных жидкостях: гексане, бензоле. Биополимеры, в состав молекул которых входит большое количество полярных функциональных групп, например, белки, полисахариды, лучше набухают в полярных растворителях: воде, спиртах и т.д.
Образование сольватной оболочки молекулы полимера сопровождается выделением энергии, которая называется теплотой набухания.
Теплота набухания зависит от природы веществ. Она максимальна при набухании в полярном растворителе ВМС, содержащего большое количество полярных групп и минимальна при набухании в неполярном растворителе углеводородного полимера.
Кислотность среды, при которой устанавливается равенство положительных и отрицательных зарядов и белок становится электронейтральным, называется изоэлектрической точкой (ИЭТ). Белки, у которых ИЭТ находится в кислой среде, называются кислыми. Белки, у которых значение ИЭТ находится в щелочной среде, называются основными. У большинства растительных белков ИЭТ находится в слабокислой среде
Набухание и растворение ВМС зависят от:
1. природы растворителя и полимера,
2. строения макромолекул полимера,
3. температуры,
4. присутствия электролитов,
5. от рН среды (для полиэлектролитов).
28)Аномальная вязкость растворов ВМС.
Вязкость раствора выражают несколькими величинами: удельная вязкость, приведенная вязкость, характеристическая вязкость. Относительная вязкость является мерой изменения вязкости раствора по сравнению с вязкостью чистого растворителя. Удельная вязкость отражает возрастание относительной вязко сти по сравнению с единицей. Чтобы учесть влияние концентрации раствора, т.е. оценить, насколько велика удельная вязкость.
В растворах высокомолекулярных веществ обнаруживается аномальная вязкость: она очень высока и в противоположность первой группе жидкостей уменьшается с увеличением давления на протекающую жидкость. Большая вязкость этих растворов зависит от степени сродства между молекулами: силы сцепления гидрофильных молекул белков и полисахаридов с молекулами воды очень высоки, и вязкость их даже в очень разбавленных растворах также будет высокой. При увеличении внешнего давления на жидкость эти частицы ориентируются вдоль потока, в результате вязкость раствора уменьшается
- Осмотическое давление в жидкостях организма (кровь, лимфа, межклеточная жидкость, спинномозговая жидкость) выполняет важную физиологическую функцию, влияющую на распределение в тканях организма воды, солей и различных питательных веществ. Осмотическое давление указанных биологических жидкостей зависит главным образом от растворенных в них низкомолекулярных минеральных веществ, преимущественно хлористого натрия, но также от высокомолекулярных соединений, находящихся в коллоидном состоянии, главным образом белков. Несмотря на то, что в плазме крови содержится от 6 до 8% белков, коллоидо-осмотическое давление составляет примерно 0,5% (30—40см водного столба) от общего осмотического давления плазмы, причем около 80% онкотического давления обусловлено наиболее низкодисперсными белками — альбуминами, а остальные 20% падают на другие белки плазмы. Существенным физиологическим моментом, связанным с важнейшими процессами, происходящими в организме, является под держание состояния осмотического равновесия между кровью и тканевыми жидкостями, которое, будучи динамическим, обеспечи вает постоянный обмен жидкости, низкомолекулярных питатель ных веществ и конечных продуктов обмена. Распределение воды и минеральных веществ между кровью и тканями и поддержание осмотического равновесия обеспечивается в основном нормальной концентрацией белков в плазме крови, а кровяное давление компенсируется колло идно-осмотическим давлением.. Аналогичные процессы имеют место и в почках при образовании мочи. При понижении содержания белка в крови, т. е. при гипопротеинемиях, вследствие голодания, нарушений деятельности пищеварительного тракта или потери белка с мочой при заболеваниях почек, возникает разница в онкотическом давлении в тканевых жидкостях и в крови. Вода уст ремляется в сторону более высо кого давления — в ткани; возни кают так называемые онкотические отеки подкожной клетчатки.
Часть осмотического давления крови, создаваемая растворенными в ней белками, называется онкотическим давлением
29.Классификация сложных белков
Сло́жные белки́ (протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы:
● Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
● Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
● Металлопротеины, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
● Нуклеопротеины, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом[2].
● Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока
● Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.
30. Гемопротеины. Сравнительная характеристика структур и функций миоглобина и гемоглобина. Гемопротеины, гемопротеиды — простые белки, связанные с окрашенным небелковым компонентом. Различают Г. (содержат в качестве простетической группы железо), магнийпорфирины и флавопротеины (содержат производные изоаллаксазина). К Г. относятся цитохром с, миоглобин, гемоглобин и др. Г. участвуют в таких фундаментальных процессах жизнедеятельности, как фотосинтез, дыхание клеток и целого организма, транспорт кислорода и СО2, окислительно-восстановительные реакции, свето- и цветовосприятие и др.
Миоглобин- сложный белок третьего уровня структурной организации. Состоит из одной полипептидной цепи (153 остатка). Третичная структура белка образована, главным образом, альфа-спиралями вторичной структуры, на которые приходится около 70 процентов АКО, остальные- на повороты и начальный и конечный участки. Белок содержит в себе так называемый ГЕМ- комплекс порфирина и иона железа в степени окисления +2.
Миоглобин сосредоточен, главным образом, в мышцах и его главной функцией является хранение кислорода. Скорость насыщения миоглобина кислородом намного превышает таковую для гемоглобина. Миоглобин мало приспособлен для транспортировки кислорода из легких в ткани, поскольку скорость отдачи кислорода в тканях невелика.
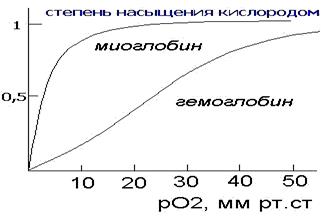
Гемоглобин представляет собой белок четвертичной структуры, состоящий из двух пар субъединиц альфа- (141 АКО) и бетта- (147 АКО- аминокислотных остатков). Субъединицы миоглобина и гемоглобина очень сходны между собой, как весьма сходна и третичная структура обоих белков.
Главное отличие гемоглобина от миоглобина заключается в проявлении особого рода эффектов- кооперативных, влияющих на скорости присоединения- отсоединения молекул кислорода. Каждая молекула гемоглобина способна присоединять и переносить четыре молекулы кислорода, при этом кооперативность проявляется в том, что как присоединение, так и отсоединение каждой последующей молекулы кислорода облегчается в результате структурных изменений в конформации молекулы, которых у гемоглобина имеется две основных- оксигенированная и дезоксигенированная. Промежуточные состояния нестабильны. Предполагается следующий механизм кооперативного эффекта. Присоединение первой молекулы кислорода приводит тому что атом железа смещается от своего места, вызывая изменения конформации субъединицы. Изменившаяся конформация по аллостерическому эффекту облегчает присоединение кислорода к другой субъединице и т.д. Это позволяет максимально ускорить процесс присоединения кислорода в легких.
31. Кооперативное связывание кислорода гемоглобином, эффект Бора, влияние 2,3-БФГ на сродство гемоглобина к кислороду.
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород "вытесняет" ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
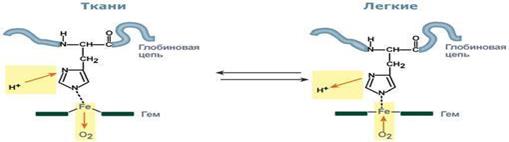
Механизм эффекта Бора
 2020-06-29
2020-06-29 116
116








