Урок в 11 классе по теме «Опыты Резерфорда. Ядерная модель атома. Постулаты Бора» 2020
I. Изучение нового материала
1.В 1911-1913 годах Э. Резерфорд (Англия) провел эксперименты по исследованию модели атома.
Применялись α-частицы, который испускались радиоактивным радием. Пучок этих частиц направлялся на сверхтонкую золотую фольгу, толщина которой была всего 400 нм. Частицы, прошедшие сквозь фольгу, регистрировали на экране с помощью микроскопа. Альфа-частицы обладали положительным зарядом, в два раза большим элементарного и массой, в 4 раза больше атомной единицы массы. Если теория Томсона верна, то альфа-частицы не должны были сильно отклоняться от своих траекторий. Однако на деле все получилось иначе. Некоторый проходили сквозь фольгу без отклонения, другие отклонялись на различные углы, третьи отклонялись на углы в 900 и более, а были и такие, которые даже возвращались обратно.
Опыты доказали, что положительный заряд атома сосредоточен в его малой области. Резерфорд предложил называть эту малую область ядром атома. В ядре сосредоточен весь положительный заряд атома и почти вся его масса (99,96%)
2.Резерфорд предлагает ядерную модель атома:
1) В центре атома расположено ядро размером 10-14 м, его заряд q=+Ze, где Z – порядковый номер в таблице Менделеева.
2) 99,96% массы атома сосредоточено в ядре
3) Ядро имеет положительный заряд
4) Электроны под действием кулоновских сил движутся вокруг ядра по замкнутым орбитам, Число электронов равно Z, суммарный заряд всех электронов q= -Ze
5) Атом в целом нейтрален
3.Так как данная модель напоминает Солнечную систему, то ее называют планетарной.
4.Все было бы хорошо, но возникли некоторые противоречия с классической физикой. Так как электроны движутся по круговым орбитам, то они обладают центростремительны ускорением. Это должно сопровождаться постоянным излучением электромагнитной энергии. И по расчетам через 10-13 с электроны должны приблизившись к ядру на него упасть и атом прекратить свое существование. Однако, на деле атомы довольно живучи. Резерфорд данный факт не смог объяснить.
Задания по рассмотренному материалу.
1.Определить количество электронов, заряд всех электронов, заряд ядра и заряд атома вольфрама 74184W. (74, 118,4·10-19 Кл)
2.Определить суммарный заряд всех ядер алюминия массой 10-3 г. 13Al (46,2 Кл)
3.№1233 На какое наименьшее расстояние альфа-частица, имеющая скорость 19 Мм/с, может приблизиться к ядру атома золота, двигаясь по прямой, проходящей через центр ядра. Масса альфа-частица 6,6·10-27 кг, заряд ее 3,2·10-19 Кл, заряд ядра золота 1,3·10-17 Кл. Вначале альфа-частица расположена очень далеко от ядра золота. (3,1·10-14 м)
4.Протон со скоростью 3 Мм/с движется к ядру атома свинца 82Pb. В начале протон находится очень далеко от ядра атома свинца. (2,5 пм)
Постулаты Нильса Бора
1.Для того, чтобы разрешить противоречия между классической физикой и моделью атома Резерфорда, Нильс Бор в 1913 г предложил квантовую модель атома, основанную на двух постулатах:
1) Атом может находиться в особых стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия. В стационарном состоянии атом не излучает. Стационарные состояния пронумерованы n=1,2,3,…. Каждому состоянию соответствует своя энергия.
2) Атом может перейти из одного стационарного состояния в другое. При этом переходе испускается или поглощается квант электромагнитной энергии, частота которого равна разности энергий атома в данных состояниях, деленная на постоянную Планка.
2.Состояние атома, которому соответствует наименьшая энергия, называется основным, а состояния, которым соответствуют большие значения энергии – возбужденными. Основное состояние у атома может быть только одно, а вот возбужденных – бесконечное множество. В основном состоянии атом может находиться бесконечно долго, а в возбужденном – порядка 10-8 с. Это время жизни атома в возбужденном состоянии.
Для более наглядного понимания процессов применяется так называемая диаграмма энергетических уровней. Применяется она для атома водорода!
Мысленно разрезаем орбиты и изображаем их в виде отрезков. Каждый такой отрезок – это орбита электрона в атоме водорода. Нижний отрезок соответствует ближайшей к ядру орбите, и так далее.
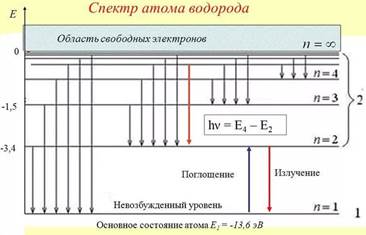 На первом энергетическом уровне энергия атома водорода Е1= -13,6 эВ.
На первом энергетическом уровне энергия атома водорода Е1= -13,6 эВ.
На любом другом уровне (орбите) энергию можно найти по формуле
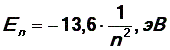
n – номер орбиты.
 2020-06-29
2020-06-29 101
101







