Амины
Теория
Перечень вопросов, рассматриваемых в теме:
Определение, номенклатура и классификация аминов
Изомерия.
Физические свойства.
Химические свойства.
Получение аминов.
Применение.
Определение, номенклатура и классификация аминов
Амины - это производные аммиака, в которых один или несколько водородов заменены на углеводородный радикал.
Общая формула аминов с углеводородным радикалом алкил:
Номенклатура.
Назвать амины, учитывая некоторые правила:
1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин.
2. Различные радикалы перечисляются в алфавитном порядке.
3. При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 метиламин
CH3 -NH-CH3диметиламин
(CH3)3-N триметиламин
Радикал метил, он один, название амина – метиламин.
Если радикала два, и они одинаковые, то диметиламин.
Если три водорода замещены на одинаковые радикалы – триметиламин.
Классификация.
Классификация аминов по числу замещенных атома водорода:
1. Первичные (один углеводородный заместителя)
2. Вторичные (два радикала);
3. Третичные (три радикала).
Классификация по строению углеводородного радикала:
1. Алифатические (не циклические, не содержат ароматических связей);
2.Алициклические (содержат цикл в составе);
3.Ароматические (содержат ароматическое кольцо);
4.Смешанного типа.
Мы рассматриваем алифатические (алкильные) амины.
2. Изомерия.
Изомерия аминов:
Структурная изомерия
- углеродного скелета, начиная с С4H9NH2:

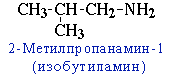

- положения аминогруппы, начиная с С3H7NH2:

Физические свойства.
По аналогии с аммиаком низшие амины (метиламин, диметиламин, триметиламин) – газы, пахнут аммиаком, хорошо растворимы в воде. Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа.
Средние амины (при увеличении атомов углерода в радикале, начиная с трех, кроме триметиламина) – жидкости, высшие (более 10 атомов углерода в радикале) – твердые вещества, при этом с ростом углеводородного радикала растворимость аминов уменьшается.
Из-за наличия водорода в первичных и вторичных аминах при азоте амины могут образовывать водородные связи с кислородом воды и другими аминами.
Как и аммиак, растворы аминов показывают щелочную среду: лакмус окрашивают в синий цвет, так как аммиак с водой образует гидроксид аммония (неустойчивое соединение), точно так же и амины образуют с водой гидроксиды алкил аммония.
Химические свойства.
1. Взаимодействие с водой. По аналогии с аммиаком, который может образовывать связи по донорно-акцепторному механизму, точно так же из-за наличия общей не поделенной пары электронов амины могут реагировать с водой с образованием гидроксидов алкиламмония. Рассмотрим на примере образования гидроксида метиламмония.
NH3 + H2O → NH4OH
R-NH2 + H2O → [R-NH3]+OH-
Вопрос: как вам кажется, алифатические амины сильнее или слабее проявляют основные свойства по сравнению с аммиаком?
Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота(смещается к азоту). По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку не поделенная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
C6H5NH2< NH3< RNH2< R2NH < R3N
основные свойства усиливаются, из-за влияния типа и числа радикалов.
2. Взаимодействие с кислотами(донорно-акцепторный механизм):
CH3-NH2 + H2SO4→ [CH3-NH3]HSO4(соль – гидросульфат метиламмония)
или
2CH3-NH2 + H2SO4→ [CH3-NH3]2SO4(соль - сульфат метиламмония)
3. Реакция горения (полного окисления) аминов на примере метиламина:
4СH3NH2 + 9O2→ 4CO2 + 10H2O + 2N2
При горении аминов образуется углекислый газ, пары воды и азот как простое вещество.
4. С галогенпроизводными (для получения вторичных и третичных аминов).
СH3NH2+ СH3Cl→СH3-NH-СH3 + HCl
Точно так же диметиламин будет взаимодействовать с метилхлоридом.
5. С азотистой кислотой (HNO2):
Первичные алифатические амины c HNO2 образуют спирты:
R-NH2 + HNO2→ R-OH + N2↑ + H2O
Вторичные амины (алифатические и ароматические) под действием HNO2 превращаются в N-нитрозопроизводные (вещества с характерным запахом):
R2NH + H-O-N=O → R2N-N=O + H2O (диалкилнитрозамин)
Реакция с третичными аминами приводит к образованию неустойчивых солей.
5.Получение аминов:
1. Восстановление нитросоединений:
СH3-NO2 + 6[H] t,kat-Ni→ СH3-NH2 + 2H2Oили
СH3-NO2 + 3H2t,kat-Ni→ СH3-NH2 + 2H2O
2. Нагреванием галогеноалканов с аммиаком под давлением (промышленный способ).
CH3Cl + 2NH3t, ↑p→ CH3-NH2 + NH4Cl
3. Действие щелочей на соли алкиламмония (лабораторный способ) (получение первичных, вторичных, третичных аминов):
[R-NH3]Сl + NaOHt→ R-NH2 + NaCl + H2O
4. Пропусканием паров спирта и аммиака при 300оС над катализатором.
С2Н5ОН + NН3 → С2Н5-NН2 +Н2О
Применение.
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает полиамидные волокна.
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты)
Анилин – это ароматический амин. Его называют так, потому что аминогруппа у него связана непосредственно с атомом углерода бензольного кольца.
Анилин, или фениламин, имеет формулу С6H5NH2.
Он представляет собой бесцветную маслянистую жидкость с характерным запахом, мало растворим в воде, но хорошо растворяется в этаноле и бензоле. (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Рассмотрим химические свойства анилина. Он реагирует с кислотами. Так, в реакции анилина с соляной кислотой образуется хлорид фениламмония.
С6H5NH2 + HCl → [С6H5NH3]+ Cl- Эта реакция подтверждает тот факт, что аммиак и амины – основания, причём амины более сильные основания.
Для анилина характерна реакция горения, при этом образуется оксид углерода (IV), азот и вода.
4CH3NH2 + 9O2 → 4CO2↑ + 2N2↑ + 10H2O
Для анилина характерны реакции галогенирования. Так, в реакции анилина с бромной водой образуется белый осадок 2,4,6-триброманилина.
C6H5NH2 + 3Br2 → C6H2NH2Br3↓ + 3HBr
Эту реакцию используют для обнаружения анилина..
В реакции анилина с хлорангидридом уксусной кислоты получают ацетанилид, который использовали как первое синтетическое жаропонижающее средство.
В реакции анилина с серной кислотой образуется вещество, которое называют ещё сульфаниловой кислотой, это вещество используют как промежуточное вещество в синтезе лекарственных средств и красителей.
С древних времён люди использовали природный краситель синего цвета – индиго. Из-за того, что этот краситель стоил очень дорого, учёные давно пытались его синтезировать.
В 1841 г русский химик Зинин открыл способ восстановления нитробензола до ароматического амина – бензамида.
Николай Николаевич Зинин − выдающийся русский химик-органик, академик Петербургской академии наук, первый президент Русского химического общества.
Анилин в лаборатории получают восстановлением нитробензола железом в присутствии соляной кислоты.

В промышленности анилин получают по реакции Зинина, то есть восстановлением нитробензола. Эта реакции идёт под давлением в присутствии катализаторов.

2. Практическое задание
Химический диктант по теме: “Амины”
вариант выполняют Агафонов М. Александрова А, Александрова П, Алешина А, Арыштаева Н, Ахтямзянов В, Боровский В, Бутонаева Р, Воробьева Н,
Прочитайте внимательно тексты. Вставьте пропущенные слова, словосочетания, формулы.
- Амины по числу углеводородных радикалов можно разделить на три группы: …., …, ….
- Вещество с формулой С2Н5 – NН – С2Н5 называется …
- Метиламин — …. с резким аммиачным запахом, хорошо растворим в воде
- Горение метиламина выражается уравнением:
4СН3NH2 + 9О2 –> 4… + 10…+ 2N2
- Характерное химическое свойство аминов заключается в образовании солей при взаимодействии с кислотами, поэтому амины — органические ….
- Качественной реакцией на анилин является реакция с ….
- Впервые анилин получил русский химик …
Химический диктант по теме: “Амины”
 2020-06-29
2020-06-29 92
92







