Этилен для органической химии – это уже не кирпичик, а целый блок.
Молекула этилена состоит из двух атомов углерода и четырёх атомов водорода. Ведь во всех органических соединениях углерод должен быть четырёхвалентным, а в С2Н4 каждый углеродный атом связан с другим углеродом и двумя водородами, т.е. как бы трёхвалентен.
Никакого нарушения четырёх валентности не наблюдается: два атома углерода связаны между собой не простой, а двойной связью. Каждая валентность обозначается чертой, и если соединить два атома углерода двумя черточками, то мы сохраним четырёхвалентность углерода.

Атомы в большинстве молекул прочно удерживаются вместе благодаря действию так называемых ковалентных связей, и имеющих очень важное значение; для этого типа связи характерно то, что пара электронов, осуществляющая связь, одновременно принадлежит связываемым атомам.
Такая связь имеет настолько большое значение, так широко представлена в различных веществах, что профессор Калифорнийского университета Джильберт Ньютон Льюис (1875-1946), открывший её электронную природу, назвал её чисто химической связью.

Строение атома углерода изображают следующей схемой

По Бору, каждой из круговых орбит соответствует конкретное энергетическое состояние электрона (энергетический уровень).
Так как на втором энергетическом уровне Р-подуровне имеется свободная орбиталь, то на неё может перейти один из 2s2-электронов. Если электрон, поглотив энергию, переходит на более удалённую от ядра орбиту, то это означает переход атома из основного (стационарного) состояния в возбужденное (нестационарное).

В результате все четыре наружных электрона второго энергетического уровня в атоме углерода окажутся неспаренными, и атом углерода в возбужденном состоянии становится четырёхвалентным.
Облака S-электронов имеют форму сферы, облака Р-электронов выглядят симметричными восьмёрками, причём эти восьмёрки могут быть расположены в пространстве вдоль осей Х, Y, Z. Однако такое положение энергетически не выгодно. Возникает противоречие, что неравноценные по исходному состоянию электроны образуют равноценные связи. Для объяснения этих фактов Лайнус Поллинг ввёл понятие гибридизация орбиталей, согласно которому происходит смешивание, усреднение имеющихся орбиталей.

В молекуле этилена подвергаются гибридизации одно -s и два из трёх
Р-электронных облака атомов углерода, то такой её вид называется SP2-гибридизацией. Это второе валентное состояние углерода.
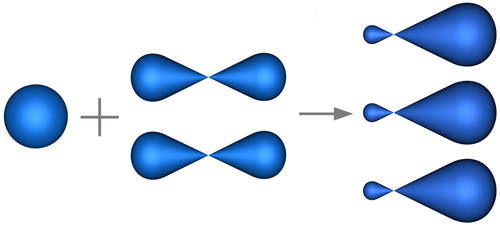
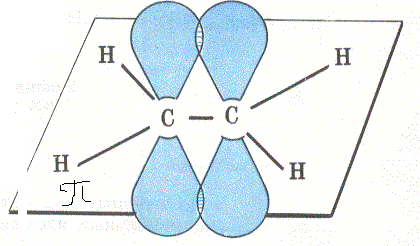
Два из шести гибридных электронных облаков атомов углерода взаимно перекрываются и образуют между атомами углерода сигма связь. Остальные четыре гибридных электронных облака атомов углерода перекрываются в той же плоскости с четырьмя S-электронными облаками атомов водорода и также образуют четыре сигма связи.

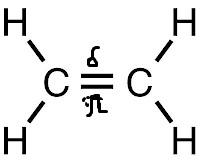
Вспомним, у нас остался ещё Р-электрон. Он образует облако в виде симметричной восьмёрки, которая направлена перпендикулярно плоскости трёх SP2-орбиталей. Эти-то электронные облака (по одной восьмёрке от каждого углерода) тоже могут перекрываться между собой, только не «лоб в лоб», как перекрываются две SP2-орбитали, а «боками». Такое перекрывание и обозначает вторая черточка. Связь первого типа (лбами) обозначает сигма связь, при которой электронные облака перекрываются «боками» называются Пи связью. Всё вместе это и есть двойная связь. Двойная связь короче простой, её длина 0,134 нм.
| Молекула С2Н4 плоское строение |
Итак, разобрано устройство ещё одной детали. Из которых можно строить «здания» органических соединений.
 2020-06-29
2020-06-29 761
761








