Выполните тестовое задание.
1) Для какого вещества характерна водородная связь:
а) CH б) CHOH в) CH-O-CH г) CHCOOCH
2) Укажите вещество с металлической связью:
а) оксид магния б) сера в) медь г) нитрид лития
3) Установите соответствие между формулой вещества и
видом химической связи в нем:
а) CaCl2 б) SO2 в) KOH г) Fe д) N е) H2O
1) металлическая 2) только ионная
3) только ковалентная полярная 4) ковалентная полярная и ионная
5) ковалентная полярная и неполярная 6) только ковалентная неполярная
7) ковалентная полярная и водородная
4). Вещество, между молекулами которого существует водородная
связь: а) этанол б) метан в) водород г) бензол
5). Вещество с металлической связью: а) H2O б) Ag в) CO2 г) KF
Уважаемые студенты! Практическое задание необходимо выполнить в рабочей тетради (сфотографировать) или в формате Документа Word. Отправлять для проверки в личные сообщения на страницу ВКонтакте: https://vk.com/id343837166
Преподаватель: Острик Марина Григорьевна
Тема: Строение молекул
Дата: 28.05.2020 (1 час)
Цель: сформировать представление о строении органических молекул.
Студенты должны знать: типы гибридизации атомных орбиталей в органических соединениях
Студенты должны уметь: тип гибридизации и геометрию молекул.
План.
1. Первое валентное состояние углерода.
2. Второе валентное состояние углерода.
3. Третье валентное состояние углерода.
4. Строение молекулы бензола.
Опорный конспект
Первое валентное состояние
Атомы в большинстве молекул прочно удерживаются вместе благодаря действию так называемых ковалентных связей, и имеющих очень важное значение; для этого типа связи характерно то, что пара электронов, осуществляющая связь, одновременно принадлежит связываемым атомам.
Такая связь имеет настолько большое значение, так широко представлена в различных веществах, что профессор Калифорнийского университета Джильберт Ньютон Льюис(1875-19460), открывший её электронную природу, назвал её чисто химической связью.
Самое простое органическое соединение метан (CH4). Его молекула состоит из пяти атомов – одного атома углерода и четырёх атомов водорода.
Так, как атом углерода имеет большую электроотрицательность (2,5), чем водород(2,1), в молекуле метана происходит незначительное смещение общих электронных пар в сторону атома углерода (по Поллингу)
| Структурная формула метана |
| Электронная формула метана |


Строение атома углерода изображают следующей схемой

По Бору, каждой из круговых орбит соответствует конкретное энергетическое состояние электрона (энергетический уровень).
Так как на втором энергетическом уровне Р-подуровне имеется свободная орбиталь, то на неё может перейти один из 2s2-электронов. Если электрон, поглотив энергию, переходит на более удалённую от ядра орбиту, то это означает переход атома из основного (стационарного) состояния в возбужденное (нестационарное).

В результате все четыре наружных электрона второго энергетического уровня в атоме углерода окажутся неспаренными, и атом углерода в возбужденном состоянии становится четырёхвалентным.
Облака S-электронов имеют форму сферы, облака Р-электронов выглядят симметричными восьмёрками, причём эти восьмёрки могут быть расположены в пространстве вдоль осей Х, Y, Z. Однако такое положение энергетически не выгодно. Возникает противоречие, что неравноценные по исходному состоянию электроны образуют равноценные связи. Для объяснения этих фактов Лайнус Поллинг ввёл понятие гибридизация орбиталей, согласно которому происходит смешивание, усреднение имеющихся орбиталей. В молекуле метана в гибридизации участвуют один S-электрон и три Р-электрона, то такой её вид называется SP3-гибридизацией. Это первое валентное состояние атома углерода. При гибридизации взаимно изменяются первоначальная форма и энергия орбиталей, поэтому образовавшиеся гибридные орбитали отличаются от исходных. Связь, осуществляемая электронами гибридных орбиталей, намного прочнее, т.к. перекрывание происходит в значительно большей степени, чем при участии негибридных орбиталей.
| sp3 гибридизация и образование химических связей в молекуле метана |

К каждой из четырёх орбиталей атома углерода направленных к вершинам тетраэдра, подходят атомы водорода ориентированные друг к другу под углом 109°28' SP3-гибридные облака углерода и S-электронные облака водорода перекрываются, а это означает образование химической сигма связи.
| Длина простой сигма связи (С - С) равна 0,154 нм. |
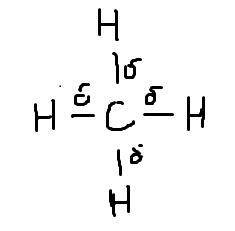
Итак, SP3-гибридные облака образуют простую, сигма связь. Метан – один из основных «кирпичиков», из которых можно строить органические соединения, сравнительно инертное вещество, имеет объёмное строение.
 2020-06-29
2020-06-29 172
172








