Молоко является сложной коллоидной полидисперсной системой, в его состав входит до 200 различных химических веществ. Все компоненты молока взаимосвязаны друг с другом и составляют стабильную систему, находящуюся в равновесии. Любые изменения в содержании и состоянии компонентов молока под воздействием тепла и холода, механических, химических факторов, рН и др. могут нарушить равновесие системы и вызвать частичную или полную потерю её компонентов и изменения свойств.
Химический состав молока может изменяться в широких пределах в зависимости от породы скота, условий его кормления и содержания, периода лактация, возраста и состояния здоровья животного, времени года и условий дойки, природно-хозяйственных и климатических условий.
Наибольший удельный вес в молоке приходится на воду (83-89%), сухое вещество (белки, липиды, углеводы, минеральные вещества и др.) составляет 11-17%, в том числе сухой обезжиренный остаток молока (СОМО) – 8-9%. Содержание сухих веществ в молоке определяет его пищевую ценность, выход молочной продукции (схема 1.).
 |
Схема 1. Средний химический состав коровьего молока
ВОДА
Вода выполняет разнообразные функции и играет важную роль в биохимических процессах. Она является растворителем органических и неорганических веществ. В водной среде проходят все многочисленные реакции живого организма. В некоторых реакциях вода принимает непосредственное участие (реакции гидролиза, окисления веществ и др.). Вода обладает особым свойством образовывать упорядоченную льдоподобную тетраэдрическую структуру. В такой структуре каждая молекула воды окружена четырьмя другими молекулами воды. Образование упорядоченной структуры объясняется тем, что молекулы воды поляризованы — каждый из двух атомов водорода молекулы обладает частичным положительным зарядом, а атом кислорода несет частичный отрицательный заряд. Следовательно, молекула воды представляет собой электрический диполь. Дипольные молекулы воды могут ориентироваться и связываться как друг с другом, так и с другими молекулами.
В молоке содержится в среднем 88% воды (с колебаниями от 86 до 89%). Вода, входящая в состав молока и молочных продуктов, неоднородна по физико-химическим свойствам, и роль ее неодинакова. Большая часть воды молока (84,5—85%) находится в свободном состоянии, т. е. может принимать участие в биохимических реакциях. Свободная вода молока представляет собой раствор различных органических и неорганических веществ (сахара, солей и пр.). Ее легко можно превратить в состояние льда при замораживании молока или удалить при сгущении и высушивании.
Меньшая часть (3—3,5%) воды находится в связанном состоянии. Связанная вода (адсорбционно связанная вода) удерживается молекулярными силами около поверхности коллоидных частиц (белков, фосфолипидов, полисахаридов). Гидратация белковых молекул обусловлена наличием на их поверхности полярных групп (гидрофильных центров). К ним относятся карбоксильные, аминные, гидроксильные и другие группы. При адсорбировании диполи воды располагаются несколькими слоями вокруг гидрофильных центров белковой молекулы.
Первый слой (ориентированные неподвижные молекулы воды, прочно связанные с белком) называют гидратной или водной оболочкой (рис. 1).
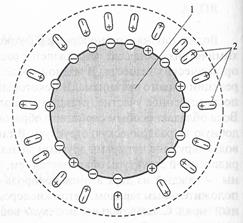
Рис. 1. Схема гидратной оболочки белковой молекулы:
1 — белок; 2 — диполи воды
От свойств гидратных оболочек зависит стабильность белковых частиц, а также жировых шариков молока. Последующие слои молекул воды связаны с белком менее прочными связями, и по свойствам она не отличается от свободной воды.
Связанная вода по своим свойствам отличается от свободной. Она не замерзает при низких температурах (ниже -40°С), не растворяет соли, сахар и т. д. Связанную воду нельзя удалить из молока при высушивании.
По количеству связанной воды обычно судят о гидрофильности белков. На практике под понятием «гидрофильность белков» чаще понимают их способность связывать всю влагу (влагу первого и последующих слоев).
Особая форма связанной воды — химически связанная вода. Это вода кристаллогидратов, или кристаллизационная вода. В молоке кристаллизационная вода связана с кристаллами молочного сахара
(С12Н22О11 • Н2О).
СУХОЙ И СУХОЙ ОБЕЗЖИРЕННЫЙ ОСТАТОК МОЛОКА
В сухой остаток, или сухое вещество, молока входят все химические составные части (жир, белки, молочный сахар, минеральные вещества и др.), которые остаются в молоке после удаления из него влаги. Содержание сухого остатка зависит от состава молока и колеблется в значительных пределах (11—14%). Среднее содержание сухих веществ в молоке, заготовляемом в различных регионах РФ, составляет около 12% с колебаниями от 11,6 до 12,4%.
Содержание сухого обезжиренного молочного остатка (СОМО) — величина более постоянная, чем содержание сухого остатка, и составляет 8—9%. СОМО определяют, вычитая из величины сухого остатка содержание жира. По нему судят о натуральности молока — если СОМО ниже 8%, то молоко, вероятно, разбавлено водой.
БЕЛКИ
Белки — высокомолекулярные полимерные соединения, построенные из аминокислот. В их состав входит около 53% углерода, 7% водорода, 22% кислорода, 15—17% азота и от 0,3 до 3% серы. В некоторых белках присутствуют фосфор, железо и другие элементы.
Все белки в зависимости от их строения и свойств делятся на две группы: простые, или протеины, и сложные, или протеиды. Протеины состоят только из аминокислот, в молекуле протеидов помимо белковой части имеются соединения небелковой природы. Например, липопротеиды кроме белка содержат липиды, гликопротеиды — углеводы, фосфопротеиды — фосфорную кислоту и пр.
Белки выполняют многочисленные биологические функции — структурную, транспортную, защитную, каталитическую, гормональную и др.
В молоке содержится в среднем около 3,2% белков, колебания составляют от 2,9% до 3,5%. Белки, входящие в состав молока, имеют сложный состав, разнообразны по строению, физико-химическим свойствам и биологическим функциям.
Используя современные способы разделения и выделения белков, исследователи установили, что в состав молока входят три группы белков:
· Казеин является главным белком молока
· Сывороточные белки
· Белки оболочек жировых шариков
И состав белков входят остатки 20 различных ɑ-аминокислот. Общая формула аминокислот следующая:

Все аминокислоты содержат аминогруппу NH2, имеющую основной характер, и карбоксильную группу СООН, несущую кислые свойства. По строению своих радикалов R, или боковых цепей, их подразделяют на ацклические и циклические. В зависимости от количества аминных или карбоксильных групп аминокислоты делят на нейтральные, кислые и основные.
Нейтральные аминокислоты имеют одну аминную (NH2) и одну карбоксильную группу (COOH).
Кислые аминокислоты представлены в белке глютаминовой кислотой (ɑ-аминоглутаровая кислота). Она имеет две карбоксильные группы (COOH) и одну аминную (NH2).
Основные аминокислоты имеют две аминные (NH2) и одну карбоксильную (COOH) группы.
Соединение аминокислот в полипептидной цепи (белковый полимер) происходит при помощи пептидной связи - СО – NH -.
Из двух аминокислот образуется дипептид, из трех — трипептид, из нескольких — полипептид.
При гидролизе (расщеплении) полипептидов разрываются пептидные связи и образуются свободные аминокислоты. Эта реакция катализируется протеолитическими ферментами и играет большую роль при переваривании белков в пищеварительном тракте, созревании сыров и т. д.
Белкам свойственны различные структуры. Последовательность аминокислотных остатков в полипептидной цепи называют первичной структурой белка (рис. 2, а). Она специфична для каждого белка.

Рис.2 Структуры белковых молекул: а -первичная; б -вторичная (ɑ-спираль); в -третичная;
г -четвертичная
В молекуле белка полипептидная цепь частично закручена в виде ɑ-спирали, витки которой скреплены водородными связями. Последние
возникают между аминными и карбоксильными группами, расположенными на противоположных витках спирали С = О...Н—N. Но не все участки белковой цепи находятся в виде а-спирали. Некоторые аминокислоты (пролин, серин и др.) препятствуют ее образованию, и в этих местах спираль прерывается. Вид спирали характеризует вторичную структуру (рис. 2,б). Возможна также слоисто-складчатая структура.
Пространственное расположение полипептидной цепи определяет третичную структуру белка (рис. 2, в).
Отдельные участки полипептидной цепи могут соединяться между собой прочными —S—S-связями (дисульфидными связями), возникающими между остатками цистеина. Важное значение в образовании третичной структуры имеют слабые связи (связи между неполярными группами аминокислот, противоположно заряженными группами, водородные связи и некоторые другие). В зависимости от пространственного расположения полипептидной цепи форма молекул белков может быть различной. Если полипептидная цепь образует молекулу нитевидной формы, то белок называется фибриллярным (от лат. fibrilla — нить), если она уложена в виде клубка — глобулярным (от лат. globulus — шарик).
В воде полипептидные цепи глобулярных белков свертываются таким образом, что почти все полярные группы располагаются на поверхности глобулы, а большинство гидрофобных скрыты внутри нее. Полярные группы обладают гидрофильными свойствами, т. е. свойствами притягивать к себе дипольные молекулы воды. При этом молекулы воды ориентируются, образуя гидратную оболочку.
Четвертичная структура характеризует способ расположения в пространстве отдельных полипептидных цепей в белковой молекуле, состоящей из нескольких таких цепей или субъединиц (рис. 2, г). Глобулярные белки, обладающие четвертичной структурой, могут содержать большое количество полипептидных цепей, тесно связанных друг с другом в компактную мицеллу, которая ведет себя в растворе как одна молекула. Так, казеиновая мицелла среднего размера должна состоять из нескольких тысяч полипептидных цепей фракций казеина, определенным образом связанных друг с другом.
Белки обладают большой молекулярной массой (от нескольких тысяч до нескольких миллионов). Вследствие большого размера белковых частиц водные растворы их представляют собой коллоидную систему, которая состоит из дисперсионной среды (растворитель) и дисперсной фазы (частицы растворенного вещества). Устойчивость коллоидных систем обуславливается наличием на поверхности частиц электрического заряда и гидратной оболочки. Нарушение этих факторов устойчивости приводит к осаждению (коагуляции) частиц.
Коагуляцию можно осуществить, добавляя в раствор белков дегидратирующие вещества (спирт, ацетон, сульфат аммония и некоторые другие соли), разрушающие гидратную оболочку. При этом происходит обратимое осаждение белков, т. е. при удалении этих веществ белки вновь переходят в нативное состояние.
При действии на белок солей тяжелых металлов, кислот и щелочей, а также при нагревании происходят необратимые реакции осаждения с потерей первоначальных свойств белка. Это явление называется денатурацией. Она характеризуется развертыванием полипептидной цепи белка, которая в нативной белковой молекуле была свернута. В результате развертывания полипептидных цепей (при разрушении третичной и вторичной структур) на поверхность белковой молекулы выходят гидрофобные группы. При этом белок теряет растворимость, агрегирует и выпадает в осадок.
КАЗЕИН
Казеин является главным белком молока, его содержание колеблется от 2,1 до 2,9%. Элементарный состав казеина (в %) следующий: углерод - 53,1; водород — 7,1; кислород — 22,8; азот — 15,4; сера — 0,8; фосфор - 0,8. Он содержит несколько фракций, отличающихся аминокислотным составом, отношением к ионам кальция и сычужному ферменту.
В молоке казеин находится в виде специфических частиц, или мицелл, представляющих собой сложные комплексы фракций казеина с коллоидным фосфатом кальция. Казеин – комплекс 4 фракций: αs1, αs2, β, χ. Фракции имеют различный аминокислотный состав и отличаются друг от друга заменой одного или двух аминокислотных остатков в полипептидной цепи.
Фракционный состав.
Казеин — комплекс четырех фракций: αs1, αs2, β, χ.
Все фракции казеина друг от друга отличаются количеством фосфорного остатка, входящих в молекулу казеина
α-казеин 45-55% 8 фосфорных остатков
β-казеин 25-35% 4 фосфорных остатков
χ-казеин 8-15% 1 фосфорный остатк
Все фракции казеина являются фосфопротеидами, т. е. содержат остатки фосфорной кислоты (органический фосфор), присоединенные к аминокислоте серину моноэфирной связью (О—Р),

Физико-химические свойства. Полярные группы, находящиеся на поверхности и внутри казеиновых мицелл (NH2, СООН, ОН и др.), связывают значительное количество воды — около 3,7 г на 1 г белка. Способность казеина связывать воду характеризует его гидрофильные свойства. Гидрофильные свойства казеина зависят от структуры, величины заряда белковой молекулы, pH среды, концентрации солей и других факторов. Они имеют большое практическое значение.
От гидрофильных свойств казеина зависит устойчивость казеиновых мицелл в молоке (связанная вода образует вокруг казеиновых мицелл защитную гидратную оболочку). Сильными гидрофильными свойствами обладают макропептиды и гликомакропептиды χ-казеина казеиновых мицелл. Поэтому при их отщеплении под действием сычужного фермента (или высоких температур) нарушается гидратная оболочка и уменьшается стабильность казеиновых частиц.
В процессе высокотемпературной обработки молока происходит взаимодействие денатурированного β -лактоглобулина с казеиновыми мицеллами. Сывороточные белки молока обладают большей гидрофильностью по сравнению с казеином, в результате чего повышаются его водоудерживающая способность. В свою очередь, гидрофильные свойства казеина влияют на способность кислотного и кислотно-сычужного сгустка удерживать и выделять влагу. Изменение гидрофильных свойств казеина необходимо учитывать при выборе режима пастеризации в процессе производства кисломолочных продуктов и молочных консервов.
От гидрофильных свойств казеина и продуктов его распада зависят водосвязывающая и влагоудерживающая способность сырной массы при созревании сыров, консистенция готового продукта. Следовательно, гидрофильные свойства казеина не только определяют устойчивость белковых частиц в молоке при его обработке, но и влияют на ход некоторых технологических процессов.
Казеин, как и все белки, содержит одновременно аминные NH2 и карбоксильные СООН группы, которые в растворе находятся в виде NH3+ и СОО-. Следовательно, казеин обладает свойствами амфотерного электролита. Количество свободных карбоксильных групп в казеине больше, чем аминных, поэтому при pH, близком к нейтральному, он имеет отрицательный заряд.
Таким образом, казеин, содержащий различные реакционноспособные группы, может образовывать целый ряд соединений со многими химическими веществами: кислотами, основаниями, альдегидами, металлами, галогенами и др.
При реакции казеина с формальдегидом происходит блокирование основных аминогрупп, что приводит к увеличению кислых свойств казеина. Эту реакцию применяют при определении содержания белков в молоке методом формольного титрования.
Свободные аминогруппы могут взаимодействовать с альдегидными группами лактозы и других сахаров с образованием аминосахарного комплекса. Эта реакция происходит во время первой стадии реакции Майара.
Карбоксильные и другие кислые группы казеина вступают в реакции с ионами металлов (Са2+, Mg2+, К+, Na+), образуя казеинаты. При иодировании тирозина, входящего в состав белка, образуется иодказеин, который сейчас применяют для ликвидирования йодной недостаточности населения.
 2020-06-29
2020-06-29 1688
1688