Соединения цинка и кадмия
Соединения со степенью окисления +2.
Цинк и кадмий образуют оксиды белого и коричневого цвета, соответственно. Получают прямым синтезом или разложением солей:
ZnСO3 = ZnO + СО2;
2Cd(NO3)2 = 2CdO + 4NO2 + O2
Гидроксиды и оксиды обладают амфотерными свойствами, однако у соединений кадмия преобладают основные свойства. Амфотерный характер Zn(OH)2 и его поведение в кислых и щелочных растворах можно отразить схемой:
+ H+ + OH- [Zn(H2O)4] 2+ ¾ Zn(OH)2 ¾® [Zn(OH)4] 2-
Кислотные свойства Cd(OH)2 проявляются только при длительном кипячении в концентрированных растворах щелочей. Образующиеся гексагидроксокадматы легко разрушаются водой.
t
Сd(OH)2¯ + 4NaOH = Na4[Cd(OH)6]
Гидроксиды цинка и кадмия растворимы в аммиачных растворах за счет образования устойчивых координационных соединений:
Zn(OH)2¯ + 4NH3 = [Zn(NH3)4](OH)2;
Сd(OH)2¯ + 6NH3 = [Cd(NH3)6](OH)2
Для цинка и кадмия известно большое число солей, из которых малорастворимы фториды, карбонаты. Цинк и в меньшей степени кадмий образуют координационные соединения как катионного, так и анионного типа. Характерные координационные числа цинка – 4 и -6, кадмия – 6. Наиболее устойчивы цианидные комплексы, которые образуются при взаимодействии нерастворимых цианидов цинка или кадмия с избытком цианида щелочного металла:
Э(CN)2¯ + 2NaCN = Na2[Э(CN)4]
Соединения кадмия весьма ядовиты!
Соединения ртути
Соединения со степенью окисления +1. Для ртути(I) известен оксид - Hg2O (черного цвета), галогениды, например, Hg2Сl2 (каломель) и некоторые соли. Большинство соединений ртути(I) бесцветны и нерастворимы в воде. Хорошо растворим нитрат ртути(I) - Hg2(NO3)2×2H2O, являющийся основным соединением при получении производных ртути(I).
Соединения ртути(I) в зависимости от условий могут проявлять как окислительные, так и восстановительные свойства. Например:
Hg2Cl2 + Cl2 = HgCl2;
Hg2Cl2 + SnCl2 = 2Hg + SnCl4
Производные катиона Hg2 2+ склонны к диспропорционированию: Hg2 2+ = Hg2+ + Hg По этой причине не удается получить по обменной реакции Hg2S и Hg2(CN)2, так как они сразу же диспропорционируют с образованием свободной ртути и нерастворимых HgS и Hg(CN)2.
Соединения со степенью окисления +2.
Оксид ртути(II) в зависимости от степени дисперсности может быть красного или желтого цвета. Оксид обладает основными свойствами, термически нестоек:
t
2HgO = 2Hg + O2
Гидроксид ртути неизвестен, уже при получении он разлагается на оксид и воду:
Hg(NO3)2 + 2KOH = HgО¯ + 2КNO3 + Н2О
При действии аммиака на соединения ртути обычно образуются амидные производные, нерастворимые в воде:
HgCl2 + 2NH3 = HgNH2Cl + NH4Cl
Галогениды HgBr2 и HgI2 в воде нерастворимы. Из солей ртути в воде растворяются сульфат и нитрат, карбонат ртути(II) неизвестен.
Координационные числа ртути(II) – 2 и 4. Координационные соединения очень устойчивы и легко образуются в растворах. Например:
HgI2¯ + 2KI = K2[HgI4];
HgS¯ + K2S = K2[HgS2];
Соединения ртути(II) проявляют окислительные свойства.
2Hg2+ + 2e- ® Hg2 2+; E0 = 0,92 В;
Hg2+ + 2e- ® Hg; E0 = 0,85 В
Например:
Hg(NO3)2 + Hg = Hg2(NO3)2;
HgCl2 + SO2 + 2H2O = Hg + H2SO4 + 2HCl
Пары ртути и ее соединения чрезвычайно токсичны!
56. Бор. Химические свойства. Отношение к кислотам, щелочам, различным окислителям. Бораны (соединения бора с водой). Борная и полиборные кислоты, их соли. Мета-, орто-, тетра- бораты.
Оксид бора — вещество белого цвета, с низкой температурой плавления, может быть аморфным или кристаллическим, гигроскопичен, типичный кислотный оксид.
Оксид бора можно получить либо непосредственным взаимодействием бора с кислородом (при 600°С), либо обезвоживанием борной кислоты:
4В + 3O2 => 2B2O3;
2H3BO3 => B2O3 + 3H2O
Аморфный оксид бора реагирует с водой с образованием борной (орто- борной) кислоты, с растворами щелочей, концентрированной фтороводородной кислотой, восстанавливается металлами:

Борные кислоты и соли борных кислот
Ортоборная кислота Н3ВO3 — бесцветное кристаллическое вещество, без запаха, растворима в горячей воде, проявляет очень слабые кислотные свойства (р К я = 9,24). Ее кислотные свойства обусловлены не отщеплением протона, а присоединением гидроксильного иона:

Присоединение иона ОН- происходит за счет электронной пары кислорода и свободной орбитали бора. Образующиеся [В(ОН)4] могут конденсироваться в растворе в одну частицу, например тетраборат ион В4O7.
Борная кислота легко вытесняется из растворов солей большинством других кислот. Соли ее, называемые боратами, обычно производятся от различных полиборных кислот, чаще всего — тетраборной Н2В4O7.
Химические свойства заключаются в следующем:
1. При нагревании происходит переход ортоборной кислоты в метабор- ную, затем в тетраборную и, наконец, в борный ангидрид:

2. Борная кислота реагирует со щелочами с образованием тетраборатов, выделяющихся из раствора в виде кристаллогидратов:


В полученном растворе имеют место следующие равновесия:

Избытком щелочи тетрабораты могут быть переведены в метабораты:

3. При взаимодействии тетраборатов с кислотами выделяется борная кислота:

4. При нагревании борная кислота растворяет оксиды металлов:

5. Со спиртами в присутствии концентрированной серной кислоты борная кислота образует эфиры:
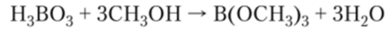
При поджигании эфир горит ярко-зеленым пламенем. Это позволяет использовать данную реакцию как качественную на кислоту и ее соли.
Бороводороды

Бораны являются необычным классом соединений бора. Простейший из них — диборан В2Н6 — является исходным веществом для синтеза всех остальных бора- нов. Его получают восстановлением соединений бора гидридом натрия при нагревании (175°С):
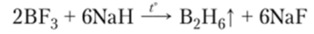
В молекуле нет непосредственной химической связи между атомами бора, а возникают две трехцентровые связи.
В сложных бороводородах (В4Н10, В5Н9, В6Н10) имеются как трехцентровые связи, так и связи непосредственно между атомами бора.
Бораны ядовиты, обладают неприятным запахом, хорошо растворяются в органических растворителях. Диборан В2Н6 — газ, пентаборан В5Н9 - жидкость, декаборан В10H14 — твердое вещество.
Химические свойства заключаются в следующем:
1. Бороводороды гидролизуются с выделением водорода:

2. Образуют устойчивые комплексные соединения с гидридами щелочных металлов:

Полученные тетрагидробораты применяются в органической химии в качестве восстановителей.
57. Алюминий. Получение металлического алюминия. Его химические свойства. Алюминотермия. Отношение алюминия к кислотам и щелочам, различным окислителям. Оксид и гидроксид алюминия, алюминаты и гидроксокомплексы. Галогениды алюминия как кислоты Льюиса.
Алюминий — элемент 13-й (III)группы периодической таблицы химических элементов с атомным номером 13. Обозначается символом Al. Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Оксид алюминия Al2O3 — в природе распространён как глинозём, белый тугоплавкий порошок, по твердости близок к алмазу.
Оксид алюминия – природное соединение, может быть получен из бокситов или при термическом разложении гидроксидов алюминия:
2Al(OH)3 = Al2O3 + 3H2O;
Al2O3 - амфотерный оксид, химически инертен, благодаря своей прочной кристаллической решетке. Он не растворяется в воде, не взаимодействует с растворами кислот и щелочей и может реагировать лишь с расплавленной щелочью.
Около 1000°С интенсивно взаимодействует со щелочами и карбонатами щелочных металлов с образованием алюминатов:
Al2O3 + 2KOH = 2KAlO2 + H2O;
Al2O3 + Na2CO3 = 2NaAlO2 + CO2.
Другие формы Al2O3 более активны, могут реагировать с растворами кислот и щелочей, αAl2O3 взаимодействует лишь с горячими концентрированными растворами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Амфотерные свойства оксида алюминия проявляются при взаимодействии с кислотными и основными оксидами с образованием солей:
Al2O3 + 3SO3 = Al2(SO4)3 (основные свойства),
Al2O3 + Na2O = 2NaAlO2 (кислотные свойства).
Гидрокси́д алюми́ния, Al(OH)3 — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами. Получают при взаимодействии солей алюминия с водными растворами щёлочи:
AlCl3+3NaOH=Al(OH)3+3NaCl
Гидроксид алюминия – типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах:
2Al(OH)3 + 6HCl = 2AlCl3 + 6H2O.
Al(OH)3 + NaOH + 2H2O = Na[Al(H2O)2(OH)4].
При нагревании разлагается, процесс дегидратации довольно сложен и схематично может быть представлен следующим образом:
Al(OH)3 = AlO(OH) + H2O.
2AlO(OH) = Al2O3 + H2O.
Алюминаты — соли, образующиеся при действии щёлочи на свежеосаждённый гидроксид алюминия:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Алюминаты получают также при растворении металлического алюминия (или Al2O3) в щелочах:
2Al + 2NaOH + 6Н2О = 2Na[Al(OH)4] + ЗН2
Гидроксоалюминаты образуются при взаимодействии Al(OH)3 с избытком щелочи:
Al(OH)3 + NaOH (изб) = Na[Al(OH)4]
Соли алюминия.
Из гидроксида алюминия можно получить практически все соли алюминия. Почти все соли алюминия хорошо растворимы в воде; плохо растворяется в воде фосфат алюминия.
В растворе соли алюминия показывают кислую реакцию. Примером может служить обратимое воздействие с водой хлорида алюминия:
AlCl3+3Н2O --- Аl(ОН)3+3НСl
Практическое значение имеют многие соли алюминия. Так, например, безводный хлорид алюминия АlСl3 используется в химической практике в качестве катализатора при переработке нефти
Сульфат алюминия Al2(SO4)3•18Н2O применяется как коагулянт при очистке водопроводной воды, а также в производстве бумаги.
Широко используются двойные соли алюминия — квасцы KAl(SO4)2•12H2O, NaAl(SO4)2•12H2O, NH4Al(SO4)2•12H2O и др. — обладают сильными вяжущими свойствами и применяются при дублении кожи, а также в медицинской практике как кровоостанавливающее средство.
Применение.
Благодаря комплексу свойств широко распространён в тепловом оборудовании. Алюминий и его сплавы сохраняют прочность при сверхнизких температурах. Благодаря этому он широко используется в криогенной технике. Алюминий - идеальный материал для изготовления зеркал.
В производстве строительных материалов: как газообразующий агент. Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам. Сульфид алюминия используется для производства сероводорода. Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала.
В качестве восстановителя: Как компонент термита, смесей для алюмотермии.
В пиротехнике: Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов (Алюминотермия).
Алюминотермия — способ получения металлов, неметаллов (а также сплавов) восстановлением их оксидов металлическим алюминием:
2Al + Cr2О3 = Al2О3 + 2Cr
 2020-07-12
2020-07-12 3979
3979