Особенность электрохимических реакций – это ОВР, протекающие в пограничной области металл (проводник)/раствор, т.е. на поверхности электродов (анода и катода), с участием электронов.
При погружении в воду или раствор соли металлической пластинки, то под действием полярных молекул воды, металл посылает в раствор электроны,
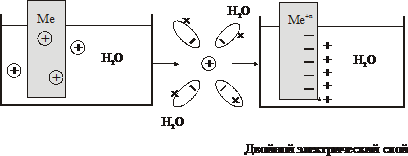
по схеме:
Мео – nē = Меn+
Меn+ + nē = Мео
С течением времени устанавливается динамическое равновесие:
Meо + m H2O 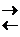 Me(H2O)mn+ + nē
Me(H2O)mn+ + nē
Или упрощенно Мео 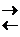 Меn++ nē
Меn++ nē
Выделяют два случая (для активных и малоактивных металлов):
1. активные металлы при погружении в растворы своих солей, даже незначительных концентраций, легко посылают ионы в раствор.
на примере цинковой пластинки 
| Znо – 2ē ® Zn2+ электрод/р-р электролита Электроны остаются на пластинке и заряжают ее «–», ионы цинка перешедшие в раствор заряжают жидкость «+». На границе раздела металлической пластинки (электрода) с раствором электролита, возникает двойной электрический слой толщиной 10–7 см с определенной разностью потенциалов. |
2. малоактивные металлы
на примере медной пластинки 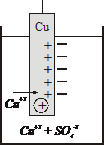
| Сu2+ + 2ē → Cuо из растворов легче переходят на пластинку (при этом происходит их восстановление) заряжая ее положительно, из-за избытка анионов раствор вокруг пластинки заряжается отрицательно. Образуется двойной электрический слой. |
Таким образом, разность потенциалов электрод/электролит называется электродным потенциалом (Е, j [В]). Он зависит от природы металла, концентрации его ионов и температуры.
Если концентрация ионов равна 1 моль/л при температуре 25 оС, то электродный потенциал обозначают jо и называют стандартным электродным потенциалом.

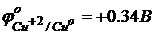 в числителе – окисленная форма, в знаменателе – восстановленная форма, знак соответствует возникающему на металле в двойном слое.
в числителе – окисленная форма, в знаменателе – восстановленная форма, знак соответствует возникающему на металле в двойном слое.
Абсолютное значение электродного потенциала определить невозможно, однако можно определить разность электродных потенциалов исследуемого металла и так называемого водородного электрода, электродный потенциал которого в стандартных условиях принят равным нулю.
Водородный электрод устроен следующим образом:
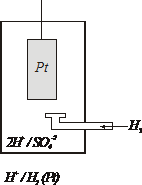
| Платиновая пластинка помещается в 1 М раствор серной кислоты. Снизу в раствор подается водород, который насыщает платину. При этом на её поверхности устанавливается равновесие Н2 – 2ē ⇄ 2Н+ Ввиду химической пассивности платины в данных условиях возникший электродный потенциал относится к водороду и обозначается |
Для определения значения потенциала металла собирают гальванический элемент из водородного электрода и испытуемого металла, погруженного в 1М раствор его соли. Разница электродных потенциалов испытуемого металла и водородного электрода принимается за электродный потенциал испытуемого металла.
 2020-07-12
2020-07-12 79
79







