Жидкости, как и твердые тела, могут быть диэлектриками или проводниками. К числу диэлектриков относится дистиллированная вода, к проводникам – растворы и расплавы электролитов: кислот, солей и щелочей.
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора: 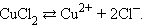
|
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду.
Степень диссоциации, т.е. доля молекул в растворенном веществе, распавшихся на ионы, зависит от температуры, концентрации раствора и диэлектрической проницаемости растворителя. С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов. Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы – рекомбинировать.
Носителями зарядов в водных растворах или расплавах электролитов являются положительно и отрицательно заряженные ионы. Если сосуд с раствором электролита включить в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду – аноду, а положительные – к отрицательному – катоду. В результате установится электрический ток. Поскольку перенос заряда в водных растворах или расплавах электролитов осуществляется ионами, такую проводимость называют ионной.
При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы отдают свои лишние электроны (окисление), а на катоде положительные ионы получают недостающие электроны (восстановление). Такие процессы называют электролизом.
Для растворов электролитов справедлив закон Ома. При постоянной температуре вольт-амперной характеристикой для растворов электролитов является прямая линия. Однако, эта прямая линия не проходит через начало координат, а «сдвинута» вправо. Это объясняется тем, что при электролизе происходит поляризация электродов, погруженных в раствор электролита, причем ЭДС поляризации имеет знак, противоположный знаку напряжения на электродах. Отрезок ОА соответствует ЭДС поляризации.
Электролиз широко применяют в технике для различных целей. Электролитическим путем покрывают поверхность одного металла тонким слоем другого (никелирование, хромирование). Это прочное покрытие защищает поверхность от коррозии. Если обеспечить хорошее отслаивание электролитического покрытия от поверхности, на которую осаждается металл, то можно получить копию с рельефной поверхности. В полиграфии такие копии получают с матриц, для чего осаждают на матрицах толстый слой железа или другого материала. Это позволяет воспроизвести набор в нужном количестве экземпляров. Такой процесс называется гальванопластика.
При помощи электролиза осуществляют очистку металлов от примесей. Так, полученную из руды неочищенную медь отливают в форме толстых листов, которые затем помещают в ванну в качестве анодов. При электролизе медь анода растворяется, примеси, содержащиеся ценные и редкие металлы, выпадают на дно, а на катоде оседает чистая медь.
 2020-07-12
2020-07-12 95
95







