I. Общие с другими солями.
1) C металлами
Металл, стоящий в ряду активности левее, вытесняет последующие из их солей:

Cu(NO3)2 + Zn = Cu + Zn(NO3)2
2) С кислотами
AgNO3 + HCl = AgCl↓ + HNO3
3) Со щелочами
Cu(NO3)2 + 2NaOH = Cu(OH)2 ↓ + 2NaNO3
4) C cолями
2AgNO3 + BaCl2 = Ba(NO3)2 + 2AgCl↓
II. Специфические. Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода. Характер других продуктов реакции зависит от положения металла, образующего нитрат, в электрохимическом ряду напряжений:

1) Нитраты щелочных (исключение - нитрат лития) и щелочноземельных металлов разлагаются до нитритов:
2NaNO3 = 2NaNO2 + O2↑
2КNO3 = 2KNO2 + O2
2) Нитраты менее активных металлов от Mg до Cu включительно и нитрат литияразлагаются до оксидов:
2Mg(NO3)2 = 2MgO + 4NO2↑ + O2↑
2Cu(NO3)2 =2CuO + 4NO2 ↑+ O2↑
3) Нитраты наименее активных металлов (правее меди) разлагаются до металлов:
Hg(NO3)2 = Hg + 2NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2 ↑+ O2↑
4) Нитрат и нитрит аммония:
Нитрат аммония разлагается в зависимости от температуры так:
NH4NO3 = N2O ↑+ 2H2O (190-245°C)
2NH4NO3 = N2↑ + 2NO + 4H2O (250-300°C)
2NH4NO3 = 2N2 ↑+ O2 + 4H2O (выше 300°C)
Нитрит аммония:
NH4NO2 = N2 ↑+ 2H2O
Разложение нитрита аммония
Исключения:
4LiNO3 = 2Li2O + 4NO2 + O2
Mn(NO3)2=MnO2 + 2NO2
4Fe(NO3)2=2Fe2O3 + 8NO2 + O2
Качественная реакция на нитрат-ион NO3– – взаимодействие нитратов c металлической медью при нагревании в присутствии концентрированной серной кислоты или с раствором дифениламина в Н2SO4 (конц.).
Протекают следующие уравнения реакций:
КNO3 (кр.) + Н2SO4 (конц.) = КНSО4 + НNО3↑
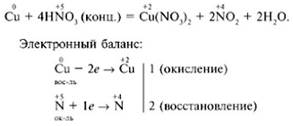
Применение нитратов
Почему азота в природе много (он входит в состав атмосферы), а растения часто дают плохой урожай из-за азотного голодания?
Растения не могут усваивать молекулярный азот N2 из воздуха. Это проблема «связанного азота». При недостатке азота задерживается образование хлорофилла, поэтому растения имеют бледно-зеленую окраску, как следствие, задерживается рост и развитие растения. Азот – жизненно важный элемент. Без белка нет жизни, а без азота нет белка.
Как же усваивается атмосферный азот? Часть связанного азота поступает в почву во время гроз. Химия процесса такова:
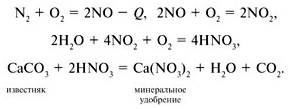
Существуют растения способные повышать плодородие почвы, в чем же их особенность? Эти растения (люпин, люцерна, клевер, горох, вика) относятся к семейству бобовых (мотыльковые), на корнях которых развиваются клубеньковые бактерии, способные связывать атмосферный азот, переводя его в соединения, доступные для растений.

 2020-08-05
2020-08-05 1294
1294








