Тема № 6. ХИМИЯ НЕМЕТАЛЛОВ
Урок № 74
Тема урока: ОКСИДЫ АЗОТА – ОБЩАЯ ХАРАКТЕРИСТИКА. АЗОТНЫЙ АНГИДРИД И АЗОТНАЯ КИСЛОТА. КАЛИЙНАЯ СЕЛИТРА И ЕЕ ПРИМЕНЕНИЕ. «ЦАРСКАЯ ВОДКА».
Цель урока: изучить оксиды азота, характеристику азотного ангидрида и азотной кислоты, калийной селитры.
ОКСИДЫ АЗОТА
В отличие от других элементов азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4, N2O5. Все оксиды азота термодинамически неустойчивы к распаду на простые вещества, однако при 700 °С реакция разложения оксидов кинетически заторможена. Рассмотрим свойства оксидов.
Оксид азота (I) N2O
Строение молекулы. Молекула N2O линейная, малополярная, её строение описывается при помощи двух резонансных структур. Связь между атомами азота равна 0,113 нм, она сравнима с длиной тройной связи.

Физические свойства. При комнатной температуре оксид азота (I) N2O – бесцветный газ, без запаха, сладковатый на вкус, растворим в воде, при 0 °С 1 объем газа растворяется в 1 объеме воды. Температура плавления -91 °С, температура кипения -89 °С. При вдыхании вызывает судорожный смех, поэтому имеет название «веселящий газ».
Химические свойства. Оксид азота (I) не взаимодействует с водой. Несолеобразующий оксид. Проявляет окислительные свойства, в нем, как и в кислороде, вспыхивает тлеющая лучина и ярко горит сера.
При нагревании выше 600 °С разлагается со взрывом:
2N2O = 2N2 + O2.
Взаимодействует с водородом:
N2O + H2 = N2 + H2O.
При поджигании смеси оксида азота (I) и аммиака происходит взрыв:
3N2O + 2NH3 = 4N2 + 3H2O.
При взаимодействии с сильными окислителями проявляет восстановительные свойства:
5N2O + 2KMnO4 + 3H2SO4 = 10NO + 2MnSO4 + K2SO4 + 3H2O.
Получение. Оксид азота (I) получают термическим разложением нитрата аммония при температуре около 200 °С:
NH4NO3 = N2O + 2H2O,
нагревание нужно проводить очень осторожно, перегрев и использование больших количеств нитрата может привести к взрыву.
Оксид азота (II) NO
Строение молекулы. Молекула NO малополярная, линейная, длина связи составляет 0,115 нм, её строение описывается двумя резонансными структурами, обе формы имеют один неспаренный электрон, поэтому молекула является радикалом, но при обычных условиях не склонна к димеризации.

Физические свойства. При комнатной температуре оксид азота (II) NO – бесцветный газ, без вкуса и запаха. Растворим в воде, при 0 °С 5 мл газа растворяется в 100 мл воды. Температура плавления -164,4 °С, температура кипения -152,2 °С.
Химические свойства. Оксид азота (II) не взаимодействует с водой. Несолеобразующий оксид. Проявляет восстановительные свойства.
Он легко окисляется кислородом:
2NO + O2 = 2NO2.
Взаимодействует с перманганатом калия в кислой среде:
5NO + 3KMnO4 + 2H2SO4 = 2MnSO4 + 3KNO3 + Mn(NO3)2 + 2H2O.
С хорошими восстановителями проявляет окислительные свойства, и восстанавливается до азота:
Реагирует с сернистым газом:
2NO + 2SO2 = 2SO3 + N2.
При использовании родиевого катализатора окисляет угарный газ в углекислый:
2NO + 2CO = 2CO2 + N2,
такие катализаторы устанавливаются в выхлопных трубах автомобилей.
Не реагирует с кислотами, при взаимодействии с расплавленной щелочью диспропорционирует:
6NO + 4KOH = N2 + 4KNO2 + 2H2O.
Получение.
В лаборатории получают действием на медь разбавленной азотной кислоты:
3Cu + 8HNO3 = 2NO + 3Cu(NO3)2 + 4H2O.
В промышленности получают каталитическим окислением аммиака на платино-родиевом катализаторе при 700 °С:
4NH3 + 5O2 = 4NO + 6H2O.
В атмосфере образуется из простых веществ в грозовых разрядах:
N2 + O2 = 2NO.
Оксид азота (III) N2O3
Строение молекулы. Молекула N2O3 плоская и состоит из фрагментов ON – NO2 c непрочной связью N – N. У атома азота имеется неподеленная пара электронов. Твердый оксид азота (III) – ионное соединение.
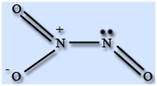
Физические свойства. Оксид азота (III) N2O3 – крайне неустойчивое соединение и существует только при низких температурах, выше 0 °С оно разлагается. Температура плавления -100 °С, температура кипения -40 °С. В твердом и жидком состоянии окрашен в синий цвет.
Химические свойства. Оксид азота (III) – типичный кислотный оксид, взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O = 2HNO2.
При взаимодействии со щелочами образуются соли азотной кислоты – нитриты:
N2O3 + 2NaOH = 2NaNO2 + H2O.
Получение.
1. Образуется при охлаждении до -36 °С смеси оксидов азота (II) и (IV):
NO + NO2 = N2O3.
2. При взаимодействии 50 %-ной азотной кислоты с оксидом мышьяка (III) при низкой температуре:
2HNO3 + As2O3 + 2H2O = 2H2AsO4 + N2O3.
3. При обезвоживании азотистой кислоты:
NaNO2 + H2SO4 = NaHSO4 + HNO2;
2HNO2 = N2O3 + H2O.
Оксид азота (IV) NO2 и N2O4
Строение молекулы. Оксид азота (IV) в широком интервале температур существует в виде равновесной смеси мономера NO2 и димера N2O4.
Молекула NO2 имеет угловую форму, предполагается, что атом азота находится в состоянии sp2-гибридизации, длина связи N – O равна 0,119 нм, что соответствует полуторной связи.

NO2
На атоме азота имеется неспаренный электрон, поэтому он легко димеризуется с образованием димера N2O4. Молекула N2O4 плоская и состоит из фрагментов2ON – NO2 c непрочной связью N – N.
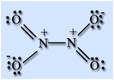
N2O4
Физические свойства. Оксид азота (IV) NO2 – бурый газ, с резким удушливым запахом, ядовит, N2O4 – бесцветен. Твердый оксид азота (IV) бесцветен и состоит только из молекул N2O4. При его нагревании до температуры плавления -12,8 °С появляется бурая окраска, которая усиливается при повышении температуры и увеличения доли мономера в смеси. Температура кипения 21,5 °С.
Химические свойства. Оксид азота, и мономер, и димер, хорошо растворим в воде, и взаимодействует с ней:
2NO2 + H2O = HNO3 + HNO2,
при этом происходит диспропорционирование на азотную и азотистую кислоты.
При температуре выше 0 °С реакция протекает по другому:
3NO2 + H2O = 2HNO3 + NO.
Если через воду пропускать смесь оксида азота (IV) и воздуха, то образуется только азотная кислота:
4NO2 + 2H2O + О2 = 4HNO3.
Диоксид азота – сильный окислитель, в его атмосфере горят углерод и сера:
С + 2NO2 = CO2 + 2NO;
S + 2NO2 = SO2 + 2NO.
Получение.
В лаборатории образуется при взаимодействии меди с горячей концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
при термическом разложении высушенных нитратов тяжелых металлов:
2Pb(NO3)2 = 2PbO + 4NO2 + O2.
В промышленности окисление оксида азота (II) кислородом:
2NO + O2 = 2NO2,
реакция является обратимой.
Оксид азота (V) N2O5
Строение молекулы. Оксид азота (V) – ангидрид азотной кислоты, построен из ионов NO2+ и NO3-, в газовой фазе и растворе состоит из молекул N2O5.

Физические свойства. Азотный ангидрид – бесцветные гигроскопичные кристаллы, температура сублимации 32,3 °С. Неустойчив и в течение нескольких часов распадается, при нагревании – со взрывом.
Химические свойства.
Разложение:
2N2O5 = 4NO2 + O2.
При растворении в воде образует азотную кислоту:
N2O5 + H2O = 2HNO3.
Является сильным окислителем:
N2O5 + I2 = I2O5 + N2.
Получение
1. Образуется при пропускании азотной кислоты через колонку с оксидом фосфора (V):
2HNO3 + P2O5 = N2O5 + 2HPO3, реакция протекает при -10 °С.
2. Получается при окислении оксида азота (IV) озоном:
2NO2 + O3 = N2O5 + O2.
HNO3 - АЗОТНАЯ КИСЛОТА
Опытным путём доказано, что в молекуле азотной кислоты между двумя атомами кислорода и атомом азота две химические связи абсолютно одинаковые – полуторные связи. Степень окисления азота +5, а валентность равна IV.

Физические свойства
Азотная кислота HNO3 в чистом виде - бесцветная жидкость с резким удушливым запахом, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет:
N2 + O2 грозовые эл.разряды→ 2NO
2NO + O2 → 2NO2
4НNО3 свет→ 4NО2↑ (бурый газ) + 2Н2О + О2
Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках.
Получение
Лабораторный способ
KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании)
Промышленный способ
Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 → 4NO + 6H2O (Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O ↔ 4HNO3
или 3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)
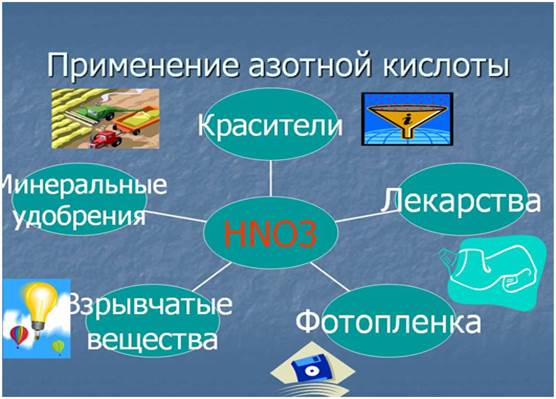
Применение
· в производстве минеральных удобрений;
· в военной промышленности;
· в фотографии — подкисление некоторых тонирующих растворов;
· в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише).
· в производстве взрывчатых и отравляющих веществ
Химические свойства азотной кислоты. Для азотной кислоты характерны свойства: общие с другими кислотами и специфические:
ХИМИЧЕСКИЕ СВОЙСТВА ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ
1. Очень сильная кислота. Индикаторы в её растворе изменяют цвет н а красный.
Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3-
 2020-08-05
2020-08-05 116
116







