- Увеличится в 5 раз
- Уменьшится в 5 раз
- Не изменится
- Может увеличиться, может уменьшиться
7. На рисунке показан график зависимости нагревания льда от времени. Какой участок графика соответствует процессу кристаллизации воды?

ЧАСТЬ В
ЧАСТЬ В
8. К каждой позиции первого столбца таблицы подберите позицию второго столбца так, чтобы получились верные утверждения.
А. При температуре 0ºС вещество 1) Вода
будет только в твердом состоянии
Б. При кристаллизации 1кг выделит 2) Ртуть
наибольшее количество теплоты
В. При температуре 0ºС вещество 3) Нафталин
Будет только в жидком состоянии
Решите задачи.
9. Какое количество теплоты выделится при кристаллизации 4кг меди и охлаждении ее до температуры 585ºС?
10. Какое количество теплоты потребуется для того, чтобы 30 г спирта, взятого при температуре 28ºС, нагреть до кипения и обратить в пар?
ЧАСТЬ С
Решите задачу. 11. Какая масса льда, взятого при температуре 0ºС, расплавится, если ему сообщить такое количество теплоты, которое выделится при конденсации стоградусного водяного пара массой 8 кг?
Варианты ответов.
| Вариант | А1 | А2 | А3 | А4 | А5 | А6 | А7 | В8 | В9 | В10 | С11 |
| 1 | 3 | 1 | 2 | 2 | 1 | 3 | 2 | 312 | 78кДж | 510кДж | 9 кг |
| 2 | 1 | 2 | 3 | 3 | 2 | 3 | 1 | 213 | 10,9кДж | 10,5Мдж | 6,8кг |
| 3 | 3 | 2 | 1 | 4 | 4 | 3 | 3 | 213 | 744кДж | 47,05кДж | 3,2 кг |
| 4 | 4 | 4 | 2 | 3 | 2 | 3 | 4 | 312 | 1,6 МДж | 30,75кДж | 54 кг |
Задача № 9 вариант 1.
Дано: Решение:
m=2 кг Q=mc (t2-t1) Q=m λ
с=140 Дж/кгºС Q1=2кг 140 Дж/кгºС (327-227)=28 000 Дж
t2=327 ºС Q2=2 кг 25 000 Дж/кг =50 000 Дж
t1= 227 ºС
λ =25000 кДж/кг Q= 28 000 Дж+50 000 Дж=78 000Дж
Q-? Ответ:Q=78 кДж
Задача № 10 вариант 1.
Дано: Решение:
m=0,2кг Q=mc (t2-t1) Q=mL
с=4200 Дж/кгºС Q1=0,2кг 4200 Дж/кгºС (100 -40)=50 400 Дж
t2=100 ºС Q2 =0,2 кг 2600 000 Дж/кг =460 000 Дж
t1=40 ºС
L=2,3 МДж/кг Q= 50 400 Дж+460 000 Дж=510 400Дж
Q-? Ответ:Q=510 кДж
Задача № 11 вариант 1.
Дано: Решение:
m1=1 кг Q=mc (t2-t1) Q=mL
с=4200 Дж/кгºС Q1=1кг 2300000Дж/кг=2300000 Дж
t2=60 ºС m2=2300000Дж:(4200Дж/кгº С 60 ºС) =9 кг
t1= 0 ºС
L =2,3 МДж/кг
m2-? Ответ: m2=9 кг
Задача № 9 вариант 2.
Дано: Решение:
m=0,1 кг Q=mc (t2-t1) Q=mλ
с=250 Дж/кгºС Q1=0,1кг 250 Дж/кгºС (232-32)=5 000 Дж
t2=232 ºС Q2=0,1 кг 59000 Дж/кг =5900 Дж
t1= 32 ºС
λ =59 кДж/кг Q= 5000 Дж+5900 Дж=10 900Дж
Q-? Ответ:Q=10,9 кДж
Задача № 10 вариант 2.
Дано: Решение:
m=4 кг Q=mc (t2-t1) Q=mL
с=4200 Дж/кгºС Q1=4 кг 4200 Дж/кгºС (100 -20)=1344000 Дж
t2=100 ºС Q2 =4 кг 2300000 Дж/кг =9200000 Дж
t1=20 ºС
L=2,3 МДж/кг Q= 1344000 Дж+9200000 Дж=10544000Дж
Q-? Ответ:Q=10,5МДж
Задача № 11 вариант 2.
Дано: Решение:
m1=1 кг Q=mc (t2-t1) Q=mL
с=4200 Дж/кгºС Q1=1кг 2300000 Дж=2300000 Дж
t2=100 ºС m2=2300000Дж: (4200Дж/кгºС 80ºС)=6,8 кг
t1= 20 ºСº
L =2,3 МДж/кг
m2-?
Ответ: m2=3,2 кг
Задача № 9 вариант 3.
Дано: Решение:
m=2 кг Q=mc (t2-t1) Q=mλ
с=4200 Дж/кгºС Q1=2кг 4200 Дж/кгºС (10-0)=84000 Дж
t2=10 ºС Q2=2 кг 330000 Дж/кг =660000 Дж
t1= 0 ºС
λ =330 кДж/кг Q= 84000 Дж+660000 Дж=744000Дж
Q-? Ответ:Q=744кДж
Задача № 10 вариант 3.
Дано: Решение:
m=100г=0,1кг Q=mc (t2-t1) Q=mL
с=2350 Дж/кгºС Q1=0,1кг 2350 Дж/кгºС (35-5)=7050 Дж
t2=35 ºС Q2 =0,1 кг 400000 Дж/кг =40000 Дж
t1=5 ºС
L=400 кДж/кг Q= 7050 Дж+40000 Дж=470050Дж
Q-? Ответ:Q=47,05кДж
Задача № 11 вариант 3.
Дано: Решение:
m1=3 кг Q=mc (t2-t1) Q=mλ
с=460 Дж/кгºС Q1=3кг 460 Дж/кгºС (800-0)=1104000 Дж
t2=800 ºС m2=1104000Дж:340000Дж/кг=3,2 кг
t1= 0 ºС
λ =340 кДж/кг
m2-?
Ответ: m2=3,2 кг
Задача № 9 вариант 4.
Дано: Решение:
m=4 кг Q=mc (t2-t1) Q=mλ
с=400 Дж/кгºС Q1=4кг 400 Дж/кгºС (1085-585)=800000 Дж
t2=1085 ºС Q2=4 кг 210000 Дж/кг =840000 Дж
t1= 585 ºС
λ =210 кДж/кг Q= 840000 Дж+800000 Дж=1640000Дж
Q-? Ответ:Q=1,6 МДж
Задача № 10 вариант 4.
Дано: Решение:
m=0,03 кг Q=mc (t2-t1) Q=m λ
с=2500 Дж/кгºС Q1=0,03кг 2500 Дж/кгºС (78-28)=3750 Дж
t2=78 ºС Q2=0,03 кг 900000 Дж/кг =27000 Дж
t1=28 ºС
λ =900 кДж/кг Q= 3750 Дж+27000 Дж=30750Дж
Q-? Ответ:Q=30,75 кДж
Задача № 11 вариант 4.
Дано: Решение:
m1=8 кг Q=mLQ=mλ
λ =340 кДж/кг Q1=8 кг2300 000Дж/кг=18400000 Дж
t2=100 ºС m2=18400000Дж:340000Дж/кг=54 кг
t1= 0 ºС
L=2300 кДж/кг
m2-? Ответ: m2=54 кг
УРОК _ХИМИИ
ТЕМА_ «Основные классы соединений»
КЛАСС _8
ВИД И ТИП УРОКА: УРОК РАЗВИВАЮЩЕГО КОНТРОЛЯ
МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ: Учебник О.С. Габриелян «Химия. 8 класс.», М., Дрофа, 2010.
ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ: тексты заданий для проведения контрольной работы; вспомогательные алгоритмы, эталон контрольной работы, алгоритм исправления ошибок школьниками, система заданий для коррекции ошибок, задания, аналогичные к/р для выборочного выполнения школьниками, дополнительные задания для учащихся, которые без ошибок справились с работой – для проведения урока по анализу к/р.
ОБЩИЕ ЦЕЛИ УРОКА
Деятельностная цель: Формирование мотивации образовательной деятельности школьников на основе личностно-ориентированного подхода для контроля уровня усвоения материала по теме «Основные классы соединений». Формирование способности учащихся к осуществлению контрольной функции.
Развивающая цель: контроль и самоконтроль изученных понятий и алгоритмов.
Формы работы учащихся:
- Самостоятельная индивидуальная работа учащихся по выполнению контрольной работы, которая состоит из трёх заданий. Первое задание проверяет знание учащимися основных классов соединений и их названия. Второе – умение составлять формулы гидроксидов и оксидов по степени окисления элементов. Третье - расчётные задачи. Это позволяет проверить не только уровень специальных умений и навыков, но и степень овладения общеобразовательными компетенциями (методологические, логические умения; сравнение, сопоставление объектов по предложенным основаниям работа с информацией, представленной в разных формах и др.).
- Самоконтроль - эталонный вариант предлагается ученику для сравнения и самостоятельного оценивания собственного варианта. Для каждого задания прописаны критерии, по которым будет осуществляться контроль. Таким образом, учащиеся изначально владеют информацией о «стоимости» каждого задания и могут прогнозировать свою оценку за контрольную работу.
- Педагогический контроль – эталон находится у педагога. Способность к самооценке формируется путём согласования с учителем результата, на основе ранее установленных критериев и рефлексивного анализа допущенных ошибок.
Структура урока.
| № п/п | Этап урока | Деятельность учителя | Деятельность учащихся | УУД |
| 1 | Мотивация к контрольно-коррекционной деятельности. Продолжительность 2-3 минуты. | Применяет прием «До-после», в ходе которого школьники сами формулируют цель урока, создаёт условия для возникновения внутренней потребности включения в контрольно- коррекционную деятельность («хочу»), актуализирует требования к ученику со стороны контрольно-коррекционной деятельности («надо»). Устанавливает тематические рамки и создает основу контрольно-коррекционных действий «могу». Организовывает повторение контролируемых способов действий, сопоставление учащимися своих работ по готовому образцу. | Принимают участие в диалоге с учителем, задают вопросы. | Регулятивные целеполагание, включая постановку новых целей, преобразование практической задачи в познавательную; прогнозирование - предвосхищение результата и уровня усвоения знаний; Познавательные умение структурировать знания; Коммуникативные умение слушать и вступать в диалог; интегрироваться в группу сверстников и строить продуктивное взаимодействие и сотрудничество со сверстниками и взрослыми. |
| 2 | Контроль и самопроверка знаний. Продолжительность 37-42 минуты. | Организует индивидуальную деятельность учащихся (написание контрольной работы). Консультирует учащихся. | Индивидуальная работа. (Приложение 1). Проверяют свою работу по эталону (Приложение 2.). | Регулятивные прогнозирование - предвосхищение результата и уровня усвоения знаний; Познавательные умение структурировать знания; осуществлять выбор наиболее эффективных способов решения задач в зависимости от конкретных условий; структурировать тексты,включаяумение выделять главное и второстепенное, главную идею текста, выстраивать последовательность описываемых событий; Личностные формирование потребности в самовыражении и самореализации, позитивной моральной самооценки и моральных чувств. |
| 3 | Локализация индивидуальных затруднений. Продолжительность – 6-8 минут. | Применяет прием «З-Х-У», организует мотивирование учащихся к коррекционной деятельности. Анализирует правильность самопроверки учащимися своих работ. Уточняет алгоритм и правила устранения ошибок. | Определяют цель урока. Определяют места ошибок. Указывают способы действий. Сравнивают с эталоном и выполняют задания творческого уровня. | Познавательные действия постановки и решения проблем. установление причинно-следственных связей; |
| 4 | Целеполагание и построение проекта коррекции выявленных затруднений. Продолжительность: 10-12 минут. | Применяет прием «Связующие Алгоритмы», организует процесс обсуждения учащимися целей коррекции, а также помогает выбрать необходимые средства и способы их достижения (Приложение 4). | Формулируют индивидуальные цели и алгоритм коррекционных действий. Выбирают способ и средство коррекции. | Регулятивные постановка новых целей, преобразование практической задачи в познавательную; самостоятельно анализировать условия достижения цели на основе учёта выделенных учителем ориентиров действия в новом учебном материале |
| 5 | Реализация построенного проекта. Продолжительность 7-8 минут. | Применяет прием «Мудрые совы», организует выполнение учащимися самостоятельной работы. Осуществляет знаковую фиксацию преодоления затруднений. | Коррекция учащимися своих ошибок (работа с эталоном) в контрольной работе и применение соответствующих способов действий. Выполняют самостоятельную работу. Выполняют самопроверку. | Регулятивные контроль в форме сличения способа действия и его результата с заданным эталоном с целью обнаружения отклонений и отличий от эталона; Познавательные формулирование проблем и самостоятельное создание способов решения проблем творческого и поискового характера. |
| 6 | Обобщение затруднений во внешней речи Продолжительность – 3-4 минуты | Применяет прием «Хочу спросить». Организует обсуждение типовых затруднений. Проговаривает формулировки способов действий, которые вызвали затруднение. | Задают вопросы, участвуют в выявлении типичных ошибок. Формулируют способы действий, которые вызвали затруднение. | Коммуникативные умение слушать и вступать в диалог; интегрироваться в группу сверстников и строить продуктивное взаимодействие и сотрудничество со сверстниками и взрослыми. планирование учебного сотрудничества с учителем и сверстниками; |
| 7 | Самостоятельная работа с самопроверкой по эталону. Продолжительность – 7-10 минут | Применяет прием «Райтинг», Организует выполнение учащимися самостоятельной работы. Осуществляет знаковую фиксацию преодоления затруднений. | Выполняют самостоятельную работу. Выполняют самопроверку, выставляют себе оценку. Учащиеся, не допустившие ошибок в контрольной работе, выполняют самопроверку заданий творческого уровня по предложенному образцу (приложение 3.). | Регулятивные контроль в форме сличения способа действия и его результата с заданным эталоном с целью обнаружения отклонений и отличий от эталона; Познавательные создавать и преобразовывать модели и схемы для решения задач; осуществлять выбор наиболее эффективных способов решения задач в зависимости от конкретных условий; давать определение понятиям; устанавливать причинно-следственные связи; |
| 8 | Включение в систему знаний и повторения. Продолжительность 5-7 минут | Применяет прием «Мысли во времени», организует применение способов действий, вызвавших затруднения, повторение и закрепление ранее изученного материала и подготовка к изучению следующих разделов курса. | В течение 1 минуты учащиеся записывать свои мысли, которые "приходят в голову" и связаны со словом «Ошибка». | Регулятивные Осуществление констатирующий и предвосхищающий контроль по результату и по способу действия; актуальный контроль на уровне произвольного внимания; самостоятельно оценивать правильность выполнения действия и вносить необходимые коррективы в исполнение как в конце действия, так и по ходу его реализации; Коммуникативные задавать вопросы, необходимые для организации собственной деятельности и сотрудничества с партнёром; осуществлять взаимный контроль и оказывать в сотрудничестве необходимую взаимопомощь; адекватно использовать речь для планирования и регуляции своей деятельности. |
| 9 | Рефлексия. Продолжительность – 3-5 минут | Применяет прием «Рюкзак». Проговаривает механизм деятельности по контролю. Ведёт диалог с учащимися, в ходе которого школьники сами формулируют цель последующей деятельности. Предлагает учащимся: -зафиксировать степень соответствия поставленной цели контрольной деятельности и её результатов; - оценить полученные результаты собственной деятельности; -при необходимости определить задание для самоподготовки (домашнее задание с элементами выбора) | Принимают участие в игре, продолжая фразу «Я на уроке…» и передавая по цепочке импровизированный «рюкзак». Фиксируют степень соответствия поставленной цели контрольной деятельности и её результатов. Оценивают полученные результаты собственной деятельности. При необходимости определяют задание для самоподготовки (домашнее задание с элементами выбора). Записывают домашнее задание. | Познавательные рефлексия способов и условий действий; контроль и оценка процесса и результатов действия Личностные самоопределение на основе развития самосознания и мировоззрения |
Приложение 1.
Контрольная работа по теме
«Соединения химических элементов»
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот, солей и дайте им названия:
1 вариант – H2SO4, Na2O, CuSO4, KOH, SO3, H2S, Mg(OH)2, Al2(SO4)3, FeS, H2O, Fe(OH)3, HCl
2 вариант – Cr(OH)3, HNO3, MgCl2, LiOH, FeSO4, H2SO3, CO2, AgNO3, Na2O, HF, Fe2O3, Ca(OH)2
3 вариант – NaCl, Cu2O, Cu(OH)2, HNO2, Al2S3, H2, N2O5, Al(OH)3, FeO, BaSO4, AgOH, H2CO3.
Критерии оценки:
| Правильно указаны оксиды – 1 б. Правильно указаны основания – 1б. Правильно указаны кислоты - 1б. Правильно указаны соли - 1б. | Правильно названы все оксиды – 1 б. Правильно названы все основания – 1 б. Правильно названы все кислоты – 1 б. Правильно названы все соли – 1 б. |
| ИТОГО | 8 б. |
2. Укажите заряды ионов и степени окисления элементов в формулах веществ. Для гидроксидов (кислоты и основания) запишите формулы соответствующих им оксидов, а для соли – формулы гидроксидов.
1 вариант – CaCO3, Cr(OH)3, H2SO4
2 вариант – Mg(OH)2, H2CO3, Na2SO4
3 вариант – NaOH, HNO3, Ba(NO3)2.
Критерии оценки:
| Правильно указаны заряды всех ионов - 1б. Правильно указаны степени окисления всех элементов – 1б. Правильно записаны формулы оксидов для гидроксидов – 1 б. Правильно записаны формулы гидроксидов для соли – 1 б. |
| ИТОГО 4 б. |
3. Решите задачу. Ответ запиши с точностью до сотых.
1 вариант – Сколько граммов сахара и сколько граммов воды надо взять для приготовления 250 г 12% раствора?
2 вариант – К 100 г 30 %-го раствора сахара добавили 10 г сахара. Какова массовая доля сахара в полученном растворе?
3 вариант – К 200 г 10 %-го раствора сахара добавили 100 г воды. Какова массовая доля сахара в полученном растворе?
Критерии оценки:
| Правильно записано условие задачи - 1б. Правильно записана формула для нахождения неизвестного – 1б. Правильно сделаны вычисления – 1 б. |
| ИТОГО 3 б. |
Критерии оценки за контрольную работу
| Количество баллов | 15-14 | 13-11 | 10-8 | 7-0 |
| Оценка | «5» | «4» | «3» | «2» |
Рекомендации по проведению и проверке контрольной работы.
Контрольная работа представляется в четырёх вариантах. В каждом задании представлены критерии оценивания. Эти критерии необходимо заранее (перед началом работы) оговорить с учащимися. Ребята должны знать, какую оценку они могут получить и что для этого необходимо выполнить. Проверку контрольной работы можно организовать таким способом, чтобы учащиеся использовали другой цвет ручки. На этом этапе не предполагается выяснение причин своих ошибок и их исправление. Данный этап завершается фиксацией своих ошибок и выставлением самооценки и сдачей контрольной работы учителю. На этапе выполнения самостоятельной работы учащиеся выполняют аналогичные задания из другого варианта в контрольной работе.
Данный формат контрольных работ позволяет учителю провести поэлементный анализ качества знаний по предложенной теме с целью дальнейшей коррекции содержания и методов обучения.
Приложение 2.
Контрольная работа по теме
«Соединения химических элементов»
Эталонный вариант
1. Из перечня формул выпишите отдельно формулы оксидов, оснований, кислот, солей и дайте им названия:
1 вариант –
| Оксиды | Основания | Кислоты | Соли |
| Na2O – оксид натрия SO3 - оксид серы (VI) H2O – оксид водорода | KOH – гидроксид калия Fe(OH)3 – гидроксид железа (III) Mg(OH)2 – гидроксид магния | H2SO4 - серная H2S - сероводородная HCl – соляная (хлороводородная) | CuSO4 – сульфат меди (II) Al2(SO4)3 - сульфат алюминия FeS – сульфид железа (II) |
2 вариант –
| Оксиды | Основания | Кислоты | Соли |
| CO2 – оксид углерода (IV) Na2O – оксид натрия Fe2O3 – оксид железа (III) | Cr(OH)3 - гидроксид хрома(III) LiOH – гидроксид лития Ca(OH)2 – гидроксид кальция | HNO3 - азотная H2SO3 - сернистая HF - фтороводородная | MgCl2 – хлорид магния FeSO4 – сульфат железа (II) AgNO3 – нитрат серебра (I) |
3 вариант –
| Оксиды | Основания | Кислоты | Соли |
| Cu2O – оксид меди (II) FeO - оксид железа (II) N2O5 – оксид азота (V) | Cu(OH)2 - гидроксид меди (II) AgOH - гидроксид серебра (I) Al(OH)3 – гидроксид алюминия | HNO2 - азотистая H2CO3 - угольная H2SiO3 - кремневая | NaCl - хлорид натрия Al2S3 - сульфид алюминия BaSO4 – сульфат бария |
Укажите заряды ионов и степени окисления элементов в формулах веществ. Для гидроксидов (кислоты и основания) запишите формулы соответствующих им оксидов, а для соли – формулы гидроксидов.
1 вариант – заряды ионов: Ca2+CO32-, Cr3+(OH)3-, H2+SO42-
степени окисления: Ca+2C+4O3-2, Cr3+(O-2H+1)3-, H2+1S+6O4-2
 CaCO3→Ca(OH)2, Cr(OH)3 → Cr2O3, H2SO4→ SO3
CaCO3→Ca(OH)2, Cr(OH)3 → Cr2O3, H2SO4→ SO3
H2CO3
2 вариант – заряды ионов: Na+2SO2-4, Mg2+ (OH) -2, H+2CO2-3
степени окисления: Na+12S+6O2-4, Mg2+ (O-2H+1)2, H+2C+4O2-3
 Na2SO4→NaOH, Mg(OH)2 → MgO, H2CO3→ CO2
Na2SO4→NaOH, Mg(OH)2 → MgO, H2CO3→ CO2
H2SO4
3 вариант – заряды ионов: Ba2+ (NO3) -2, Na+OH-, H+NO-3
степени окисления: Ba+2 (N+5O2-3) -2, Na+1 O-2H+1, H+1N+5O2-3
 Ba(NO3) 2→Ba(OH)2, NaOH→ Na2O, HNO3→ N2O5
Ba(NO3) 2→Ba(OH)2, NaOH→ Na2O, HNO3→ N2O5
HNO3
3. Решите задачу.
1 вариант – Сколько граммов сахара и сколько граммов воды надо взять для приготовления 250 г 12% раствора?
 Дано: Решение:
Дано: Решение:
mр-ра= 250 г mр.в.= ω* mр-ра = 0,12*250 = 30 г
ω = 12% = 0,12 mр-ль = mр-ра - mр.в = 250 – 30 = 220 г

mр.в.= х г
mр-ль= у г Ответ: 30 г, 220 г
2 вариант – К 100 г 30 %-го раствора сахара добавили 10 г сахара. Какова массовая доля сахара в полученном растворе?
 Дано: Решение:
Дано: Решение:
m1 р-ра= 100 г m1р.в = ω1* m1 р-ра = 0,3 * 100 = 30 г
ω1 = 30% = 0,3
m р.в.= 10 г ω2= (m1р.в + m р.в)/ (m1 р-ра + m р.в) = (30+10)/100+10 = 0,37

ω2 = x % Ответ: 37%
3 вариант – К 200 г 10 %-го раствора сахара добавили 100 г воды. Какова массовая доля сахара в полученном растворе?
 Дано: Решение:
Дано: Решение:
m1 р-ра= 200 г m1р.в = ω1* m1 р-ра = 0,1 * 200 = 20 г
ω1 = 10% = 0,1
m р-ль.= 100 г ω2= m1р.в / (m1 р-ра + m р-ль) = 20/200+100= 0,07

ω2 = x % Ответ: 7%
Приложение 3.
Дополнительные задания
для учащихся, которые без ошибок справились с контрольной работой.
Вариант 1
- Составьте формулы следующих веществ: нитрита магния, бромида кальция, фосфата стронция, оксида мышьяка (V), фосфата калия, гидроксида свинца (II), оксида кремния (II), бромной кислоты (правильно составлены все формулы - 8 б.).
- Заполните таблицу по образцу (правильно составлены все формулы - 9 б.):
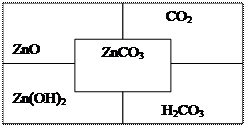
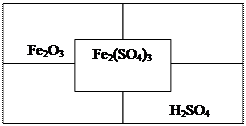
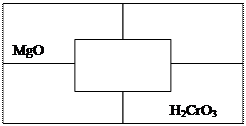
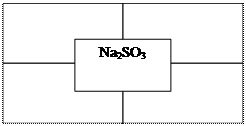
- Смешали 200 г 40 %-го и 100 г 30 %-го растворов азотной кислоты. Определите массовую долю кислоты в полученном растворе (правильно записано условие задачи, правильно записана формула для нахождения неизвестного, правильно сделаны вычисления – 3 б.).
Вариант 2.
- Составьте формулы следующих веществ: нитрата кальция, фторида алюминия, карбоната лития, оксида мышьяка (III), сульфита натрия, гидроксида железа (II), оксида меди (II), хлорной кислоты (правильно составлены все формулы - 8 б.).
- Заполните таблицу по образцу (правильно составлены все формулы - 9 б.):
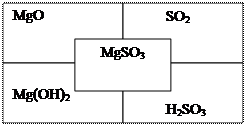
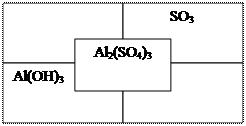
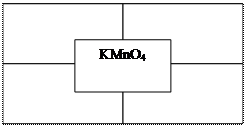

- Смешали два раствора гидроксида натрия: 120 г 5 %-го раствора и 130 г 15 %-го раствора. Рассчитайте массовую долю гидроксида натрия в полученном растворе (правильно записано условие задачи, правильно записана формула для нахождения неизвестного, правильно сделаны вычисления – 3 б.).
Приложение 4.
Алгоритм исправления ошибок школьниками:

Приложение 5.
Алгоритм конструирования урока развивающего контроля.
- Определить форму и процедуру проведения контрольной работы.
- Составить список знаний – понятий, алгоритмов, правил, способов действий и т.д., которые требуют контроля усвоения. Подобрать соответствующие эталоны.
- В соответствии с принципом минимакса подобрать задания для контрольной работы на применение перечисленных знаний.
- Составить контрольную работу.
- Подобрать задания для этапа самостоятельной работы с самопроверкой.
- Определить критерии оценивания контрольной работы и форму его представления учащимся.
- Подготовить образцы и эталоны для самопроверки.
- Определить способы организации самопроверки контрольной и самостоятельной работ.
- Продумать форму организации этапа мотивации.
- Продумать форму организации актуализации знаний.
- Продумать организацию работы с алгоритмом исправления и, при необходимости, составить диалог для его коррекции на уроке.
- Спроектировать деятельность учащихся, зафиксировавших отсутствие затруднений (подобрать задания более высокого уровня сложности, продумать способ их предъявления и проверки, продумать возможность их включения в консультационную работу и пр.)
- Продумать формы организации работы в классе на каждом этапе урока.
- Продумать форму организации этапа рефлексии.
- Сконструировать диалоги для организации коллективной работы на всех этапах урока.
- В случае организации групповой работы, сформулировать задания и способы организации обратной связи по результатам работы групп.
- Подобрать задания для этапа повторения, продумать аргументацию выбора заданий.
- Составить технологическую карту урока.
- Провести анализ технологической карты. Внести корректировку.
Алгоритм подготовки урока развивающего контроля см. Приложение 5.
 2020-08-05
2020-08-05 607
607







