Выполненную работу (скан или фото)отправьте на мою электронную почту novitskaya_60@bk.ru
Преподаватель: Новицкая Лариса Евгеньевна
Предмет: ОУД.05 История
Группа: 4-19
Тема: Колониальная экспансия европейских стран.
Изучить §65-66 Артемов В.В. Лубченко Ю.Н. История: учебник для студ. Учреждений сред.проф. образования.-М.,2014(стр. 258-264),посмотреть видеоролик https://www.youtube.com/watch?v=JE1aHjvFeb0, https://www.youtube.com/watch?v=my9MUBbcWbk, https://www.youtube.com/watch?v=g_1LKKOCJPA, https://www.youtube.com/watch?v=CBzY4j0NSIQ и ответьте на следующие вопросы:
- Где появились владения европейских государств и как они назывались?
- Что такое метрополия?
- Каковы цели метрополии по использованию колоний?
- Назовите крупные колониальные державы и в каких частях света они имели колонии?
- Какие методы управления применяла Великобритания в Индии?
- Почему восстание сипаев потерпело паражение?
- Какие последствия имело «закрытое» положение Китая для его развития?
- Назовите причины «опиумных войн»?
- Когда произошло тайпинское восстание, его причины и итоги?
- Как и когда произошло полное закабаление Китая?
- Как именно влиял на развитие Японии режим сёгуната?
- Когда произошло открытие Японии?
- Какие реформы были проведены в период Мэйдзи?
- Когда и с каких событий началась колонизаторская политика Японии?
Ответы запишите в тетради.
Выполненную работу (скан или фото)отправьте на мою электронную почту novitskaya_60@bk.ru
Огнева Е.В. Иностранный язык
Группы: 3-19, 1-19
Г.
Напоминаю, что работы выполняются в отдельных тетрадях, заведенных на период карантина. Выполнив задания, фотографируете и отправляете на электронную почту katysikrus@hotmail.com или личным сообщением ВКОНТАКТЕ, ссылка на профиль - https://vk.com/id45326507 (сообщения открыты)
Тема: Мой дом. Модальный глагол must
Отвечая на вопросы, письменно составьте рассказ о своем доме.
1. Do you live in a flat or in the house?
2. How many floors are there in your house?
3. How many rooms are there in your house?
4. Are they big or not?
5. Are there any pictures on the walls?
6. What furniture is there in your living room?
7. What colour is your house?
8. Do you have a large hall?
9. What is there in your kitchen?
10. Have you got a garden near the house?
11. Have you got a balcony?
12. Are the windows large?
13. Have you got a room of your own?
14. What do you like most of all in your house?
2. Просмотрев видео по ссылке ниже, выполните в учебнике Звенигородская, Щербакова Английский язык для специалистов сферы общественного питания (есть в электронной библиотеке техникума) упр. 10 на стр. 38
https://www.youtube.com/watch?v=kPk5nJa2hmo
30.06.2020
Преподаватель: Сухарникова Наталья Александровна
Предмет: химия
Группа ПК 19-2: Тема: d-элементы, их свойства и применение
Прочитайте информацию о d-элементах, составьте характеристику двух элементов и их соединений на выбор, используя теоретический материал. Самостоятельно найдите в интернете информацию о применении d-элементов и запишите области применения в виде уголковой схемы.
Фото с выполненными заданиями высылать на e-mail: sukharnikova@yandex.ru
d-элементы
Это металлы побочных подгрупп больших периодов; валентные электроны находятся на s – орбиталях внешнего электронного уровня и d – орбиталях предвнешнего уровня. Для этого семейства характерны следующие признаки:
1. Большинство элементов в соединениях проявляют различные степени окисления (исключение - цинк).
2. Многие соединения имеют окраску.
3. Элементы характеризуются высокой комплексообразующей способностью.
4. Если элемент образует соединения, проявляя разные степени окисления, то это часто связано с их различными кислотно-основными свойствами:
а) минимальная с.о. – основные свойства (Cr+2, Fe+2, Mn+2 );
б) промежуточная с.о. – амфотерные свойства (Cr+3, Fe+3, Mn+4);
в) максимальная с.о. – кислотные свойства (Cr+6, Fe+6, Mn+7).
5. В зависимости от степени окисления соединения по-разному ведут себя в окислительно-восстановительных реакциях:
а) если у элемента минимальная с.о., то соединения – восстановители;
б) если у элемента промежуточная с.о., то соединения – redox-амфолиты (амфотерные);
в) если у элемента максимальная с.о., то соединения – окислители.
ПОДГРУППА МЕДИ
Физические свойства: все элементы электропороводны, пластичны, находят широкое применение в технике и медицине.
Свойства элементов подгруппы меди
| Элемент | Строение валентных орбиталей | Степени окисления | Плотность (г/см3) |
| Медь 29Сu Серебро 47Ag Золото 79Au | …3d104s1 …4d105s1 …5d106s1 | +1 +2 +3 +1 +2 +3 +1 +2 +3 | 8,96 10,5 19,3 |
Химические свойства
Малоактивны, что соответствует их положению в ряду активности металлов: …Н, Cu, Hg, Ag, Au.
1.2Cu + O2 = 2CuO (или Cu2O)
Ag + O2 ¹
Au + O2 ¹
2. Cu, Ag, Au + H2 ¹
3. Cu + Cl2 = CuCl2
 реакции идут медленно
реакции идут медленно
4. Взаимодействие с кислотами:
а) Н2SO4 конц .: Cu + 2Н2SO4 = CuSO4 + SO2 + 2H2O;
2Ag + 2Н2SO4 = Ag2SO4 + SO2 + 2H2O;
Au + Н2SO4 ¹.
б) НNO3 конц; Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
Ag + 2HNO3 = AgNO3 + NO2 + H2O;
Au + HNO3 ¹.
в) НNO3 разб; 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O;
6Ag + 8HNO3 = 6AgNO3 + 2NO + 4H2O;
Au + HNO3 ¹.
г) «царская водка» - смесь НNO3 конц и НCl конц
Au + HNO3 + 3HCl = AuCl3 + NO + 2H2O
или
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O.
Индивидуальные свойства меди
Сu +: а) Cu2О – закись меди, неустойчива; красный порошок
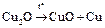
б) Соли тоже диспропорционируют:
2CuCl ® CuCl2 + Cu.
в) Комплексные соединения растворимы лучше средних солей; образуются легко:
CuCl + KCl ® K[CuCl2]; или K2[CuCl3], K3[CuCl4];
CuCl + 2NH3 ® [Cu(NH3)2]Cl.
Сu 2+: а) CuО – окись меди, чёрные кристаллы
 ;
;
б) Cu(OH)2 – голубой осадок; амфотерность практически не проявляется;
в) соли устойчивы, сине-зелёного цвета
CuSO4 × 5H2O – медный купорос;
(CuОН)2СО3 – малахит.
Хорошо вступают в реакции комплексообразования:
CuSO4 + 4NH4OH ® [Cu(NH3)4]SO4 + 4H2O.
голубой ярко-синий
Индивидуальные свойства серебра
Малоактивно, но на воздухе чернеет, т.к. идёт реакция:
4Ag + 2H2S + O2 = 2Ag2S¯ + 2H2O.
Ag +: а) Ag2O – чёрный; 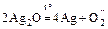 ;
;
б) 2AgNO3 + 2NaOH = 2NaNO3 + Ag2O¯+ H2O;
в) Большинство солей нерастворимы в воде, но растворяются, переходя в комплексные соединения
AgCl¯ + 2NH4OH ® [Ag(NH3)2]Cl + 2H2O;
AgBr¯ + Na2S2O3 ® Na[AgS2O3] + NaBr;
AgJ¯ + KJ ® K[AgJ2].
Ag 2+: Известны AgO, AgF2; соединения неустойчивы.
Ag 3+: Ag2O3, K[AgF4].
Все соединения – окислители и могут восстанавливаться до свободного серебра:
AgF2 + Zn = Ag + ZnF2.
Индивидуальные свойства золота
Золото – самое неактивное из металлов подгруппы, его соединения легко восстанавливаются до золота, которое существует в виде коллоида красного или розового цвета (т.н. «кассиев пурпур»).
Au +:Au2O, AuCl.
Au 3+: а) Au2O3, Au(OH)3 – неустойчивы:
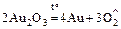 ;
;
б) AuCl3, AuBr3 в воде растворимы;
в) соединения чаще встречаются в виде комплексных соединений
Au(OH)3 + NaOH ® Na[Au(OH)4];
Au(OH)3 + 4HNO3 ® H[Au(NO3)4] + 3H2O;
AuCl3 + HCl ® Н[AuCl4];
г) окислительные свойства соединений
2AuCl3 + 3SnCl2 = 2Au¯ + 3SnCl4.
ПОДГРУППА ЦИНКА
Свойства элементов подгруппы цинка
| Элемент | Строение валентных орбиталей | Плот-ность (г/см3) | t°пл, С | Степени окисления |
| Цинк 30Zn Кадмий 48Cd Ртуть 80Hg | …3d104s2 …4d105s2 …5d106s2 | 7,1 8,7 13,55 | -39 | +2 +2 +1 +2 |
Химические свойства
В ряду напряжений их местоположение связано с химической активностью: …Zn…Cd…H, Cu, Hg…
Индивидуальные свойства цинка
1. Цинк – самый активный металл подгруппы
а) Zn + 2HCl = ZnCl2 + H2;
б) 3Zn + 4H2SO4 конц. = 3ZnSO4 + S¯ + 4H2O;
в) 5Zn + 12HNO3 разб. = 5Zn(NO3)2 + N2 + 6H2O.
2. В то же время Zn, ZnO, Zn(OH)2 амфотерны:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2;
ZnO + 2HCl = ZnCl2 + H2О;
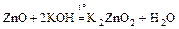 ;
;
Zn(OH)2¯ + 2HNO3 = Zn(NO3)2 + 2H2O;
Zn(OH)2¯ + 2KOH = K2[Zn(OH)4].
3. Соли гидролизуются, например раствор «цинкового купороса»
ZnSO4 × 7H2O имеет кислую среду:
2ZnSO4 + 2H2O Û (ZnOH)2SO4 + H2SO4
Zn2+ + H2O Û ZnOH+ + H+.
Индивидуальные свойства ртути
Из различных соединений ртути наиболее токсичны: ртуть металлическая Hg и соединения ртути (II).
Hg + (существует в виде иона  ); соединения малоустойчивы.
); соединения малоустойчивы.
а) Hg2O – закись ртути, чёрная;
б) Hg2Cl2 – каломель; Hg2(NO3)2 и др.
для многих соединений характерны реакции диспропорционирования:
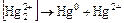 .
.
в) гидроксид неустойчив:
Hg2(NO3)2 + 2КОН = 2КNO3 + Hg2O¯ + Н2О.
г) соли проявляют окислительно-восстановительную двойственность:
Hg2Cl2 + Cl2 = 2HgCl2 (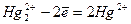 );
);
в-ль
Hg2Cl2 + SnCl2 = 2Hg + SnCl4 ( ).
).
о-ль
Hg 2+: а) HgO – окись ртути, жёлтая, красная;
б) гидроксид неустойчив:
Hg(NO3)2 + 2КОН = 2КNO3 + HgO¯ + Н2О.
в) из солей часто используют: HgCl2 – сулема; HgS – киноварь.
ХРОМ
24Cr… 4s13d5.
Физические свойства
Один из самых твёрдых металлов; режет стекло. Плотность 7,2 г/см3;
t°пл. = 1890°С.
Химические свойства
1. При обычной температуре устойчив, при повышенной взаимодействует со многими элементами:
 ;
;
2Cr + 3Cl2 = 2CrCl3;
2Cr + N2 = 2CrN.
2. Взаимодействует со сложными веществами
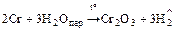
Поверхность металла обычно покрыта оксидной плёнкой, которая его «пассивирует» и поэтому при комнатной температуре хром не взаимодействует с HNO3 конц. и H2SO4 конц., но идут реакции
Cr + 2HClразб. = CrCl2 + H2;
Cr + H2SO4 разб. = CrSO4 + H2.
Полученные соли неустойчивы и переходят в CrCl3 и Cr2(SO4)3.
3. В соединениях хром проявляет следующие степени окисления:
Наиболее важные соединения хрома
| +2 | +3 | +6 |
| CrO основной оксид Cr(OH)2 CrCl2, CrSO4 соединения малоустойчивы | Cr2O3 – амфотерен Cr(OH)3 (H3CrO3), K3CrO3 ортохромиты CrCl3 (HСrO2), KСrO2 метахромиты | CrO3 – кислотный оксид H2CrO4 – хромовая кислота Me2CrO4 - хроматы H2Cr2O7 - двухромовая Me2Cr2O7 - дихроматы |
| восстановители | восстановители и окислители | Окислители |
Как правило Cr2+ ® Cr3+; например самопроизвольно при стоянии идет окисление: 4Cr(OH)2¯ + O2 + 2H2O ® 4Cr(OH)3¯.
Для соединений характерна богатая окраска:
| CrO чёрный Cr(OH)2 жёлтый CrCl2 голубой | Cr2O3 – серо-зелёный NaCrO4 – ярко зелёный K3[CrCl6] – розовый K3[Cr(SO4)3] – жёлтый | CrO3 – красный H2CrO4 – жёлтый H2Cr2O7 - оранжевый |
4. Известны перекисные соединения хрома:
CrO5, H2CrO6, соли – синие;
H3CrO8, соли – красные.
МАРГАНЕЦ
25Mn… 4s23d5
Физические свойства
Тяжёлый, серебристо-белый металл. Плотность 7,44 г/см3; t°пл. = 1245°С.
Химические свойства
Активен и поэтому покрыт оксидной плёнкой, которая защищает его.
1. Взаимодействует со многими элементами
Mn + O2 = MnO2;
Mn + Cl2 = MnCl2 (или MnCl4);
Mn + C = MnC.
2. Реакции со сложными веществами:
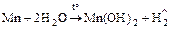 ;
;
Mn + 2HCl. ® MnCl2 + H2;
Mn + 2H2SO4 конц. = MnSO4 + SO2 + 2H2O;
3Mn + 8HNO3 конц. = 3Mn(NO3)2 + 2NO + 4H2O.
3. В соединениях проявляет степени окисления: +2, +3, +4, +5, +6, +7.
Наиболее часто встречающиеся соединения марганца представлены ниже:
Наиболее важные соединения марганца
| +2, +3 | +4 | +6, +7 |
| основный характер MnO Mn2O3 Mn(OH)2 - неуст. MnSO4 | амфотерны MnO2, MnO(OH)2 Mn(OH)4 K4MnO4 Mn(SO4)2 K2MnO3 манганиты | Кислотный характер H2MnO4 Mn2O7 K2MnO4 HMnO4 манганаты KMnO4 соли-пер- манганаты |
| соединения Mn2+ - восстановители | Mn4+ – redox-амфотерен | соединения Mn7+ - окислители |
При стоянии Mn2+ ® Mn4+: 2Mn(OH)2¯ + O2 + 2H2O ® 2Mn(OH)4¯.
4. Перманганат калия KMnO4 применяется как сильный окислитель в аналитической химии, медицине. В зависимости от среды даёт различные продукты реакции:

ЖЕЛЕЗО
26Fe… 4s23d6
Физические свойства
Серебристо-белый металл, пластичный, электропроводный, легко намагничивается. Плотность 7,87 г/см3; t°пл. = 1539°С.
Химические свойства
1. Вступает в реакции с простыми веществами:
3Fe + 2O2 = Fe3O4 (FeO × Fe2O3);
2Fe + 3Cl2 = 2FeCl3;
Fe + S = FeS;
Fe + P = FeP.
2. Взаимодействует со сложными веществами
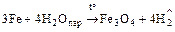 ;
;
Fe + 2HCl. = FeCl2 + H2;
Fe + 2H2SO4 разб. = FeSO4 + H2;
Fe + 4HNO3 разб. = Fe(NO3)3 + NO + 2H2O;
Fe + HNO3 конц. ¹ пассивируется;
2Fe + 6H2SO4 конц. 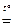 Fe2(SO4)3 + 3SO2 + 6H2O;
Fe2(SO4)3 + 3SO2 + 6H2O;
Fe + PbSO4 = Pb + FeSO4.
3. В соединениях железо проявляет различные степени окисления:
Наиболее важные соединения железа
| +2 | +3 | +6 |
| FeO основные свойства Fe(OH)2 - неустойчив FeSO4 | Fe2O3 – в основном основные свойства, амфотерность только при сплавлении Fe(OH)3 KFeO2 FeCl3 феррит получить трудно | K2FeO4, BaFeO4 ферраты неустойчивы |
| восстановители | окислители |
Под действием кислорода воздуха Fe(OH)2¯ ® Fe(OH)3¯.
4. Соли Fe2+ - жёлто-зелёные;
Соль Мора: (NH4)2Fe(SO4)2 × 6Н2 О
Соли Fe3+ - жёлто-оранжевые;
железо-аммонийные квасцы: KFe(SO4)2 × 12H2O; устойчивы при хранении.
5. Реакции открытия соединений железа:
а) качественная реакция на ион Fe2+ - реакция с «красной кровяной солью» K3[Fe(CN)6]
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2¯ + 3K2SO4.
тёмно-синий
б) качественные реакции на ион Fe3+
FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl;
тёмно-красный
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3¯ + 12KCl.
тёмно-синий
КОБАЛЬТ
27Со… 4s 23d7; по физическим и химическим свойствам похож на железо, но менее активен. В соединениях проявляет степени окисления +2, +3
+2: СоО, Со(ОН)2; средние соли весьма устойчивы, как правило розового цвета. Под действием сильных окислителей Со2+ ® Со3+:
2Со(OH)2 + NaClO + H2O ® 2Co(OH)3 + NaCl.
+3: Со(ОН)3; средние соли малохарактерны, но комплексные соли известны [Co(NH3)6]Cl3; K3[Co(NO2)6].
Реакция открытия:
СоCl2 + 4NH4SCN ® (NH4)2[Co(SCN)4] + 2NH4Cl.
розовый в ацетоне ярко-голубой
НИКЕЛЬ
28Ni… 4s23d8; по физическим и химическим свойствам похож на Fe. В соединениях проявляет степени окисления +2, +3. (Степень окисления +3 для Ni ещё менее характерна, чем для Со).
Известны соединения NiO, 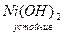 , средние соли (зелёного цвета), комплексные соли с к.ч. = 4, 6: K2[Ni(CN)4]; [Ni(NH3)6]Cl2.
, средние соли (зелёного цвета), комплексные соли с к.ч. = 4, 6: K2[Ni(CN)4]; [Ni(NH3)6]Cl2.
Реакция открытия:
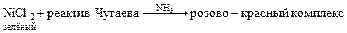
Вопросы для закрепления материала:
1.В чем можно растворить медную пластинку – а)в НС1? б)в растворе NаОН? в) в концентрированной НNO3 ?
2.Какого состава хлорид получится при нагревании хрома с хлором – а)CrCI2? б)CrCI3? в)CrCI6?
 2020-08-05
2020-08-05 61
61







